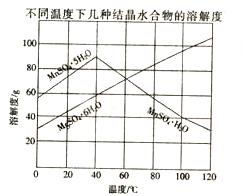
(12分) 软锰矿(主要成分MnO2,含Fe,Al2O3,MgO杂质)的水悬浊液与烟气中的SO2反应可制备MnSO4·H2O,MnO2与SO2反应的化学方程式为MnO2 +SO2=MnSO4。已知下列信息:
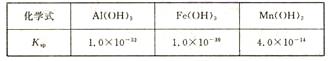
室温下几种氢氧化物的溶度积
回答下列问题:
(1)质量为17.40 g纯净MnO2最多能氧化 L(标准状况) SO2。
(2)悬浊液吸收烟气后,Fe首先转化为Fe2+进入溶液,然后被 氧化为Fe3+;要证明溶液中存在Fe3+,可选择的试剂是 (填标号)。
a.KMnO4溶液 b.KCl溶液 c.KSCN溶液 d.KNO3溶液
(3)室温下,将吸收液过滤,在滤液中加入CaCO3,可除去MnSO4溶液中的Fe3+、Al3+,原因是 。
(4)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 。
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.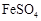 溶液与稍过量的
溶液与稍过量的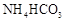 溶液混合,得到含FeCO3的浊液,同时有CO2气体放出。
溶液混合,得到含FeCO3的浊液,同时有CO2气体放出。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到FeCO3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的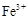 ,该反应的离子方程式是。
,该反应的离子方程式是。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用。
(3)Ⅲ中,生成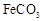 的离子方程式是。若
的离子方程式是。若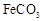 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
(4)Ⅳ中,通过检验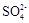 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验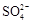 的操作是。
的操作是。
(5)已知锻烧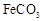 的化学方程式是
的化学方程式是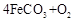

 。现锻烧464.0kg的
。现锻烧464.0kg的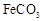 ,得到316.8kg产品。若产品中杂质只有
,得到316.8kg产品。若产品中杂质只有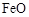 ,则该产品中
,则该产品中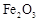 的质量是kg。
的质量是kg。
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
⑴若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为。
⑵若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为。
⑶若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为。
⑷若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为。
⑸若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式为。
(6)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的电子式为。
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2 – 2e- = 2H+ + O2↑还原反应:MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式:。
(2)反应中氧化剂是;氧化产物是;若有0.5molH2O2参加此反应,电子一转移个数为。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为;这时若有0.5molH2O2发生分解,电子转移个数为。
用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
有机物A + 有机物 C → CH2=CHCOOCH2CH3(丙烯酸乙酯)
根据以上材料和你所学的化学知识回答下列问题:
(1)由CH2=CH2制得有机物A的化学反应类型是:;
(2)丙烯醛[ CH2═CH CHO ]中含有的官能团:(填名称);
(3)A与C合成丙烯酸乙酯的化学反应方程式是:
_________________________________________________________________;
该反应的类型是反应。
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是,写出在沉淀池的离子方程式。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的。
(3)操作A是,操作B是。
(4)加入的足量试剂a是(填化学式)。