硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:
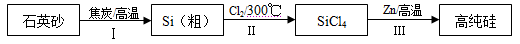
(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是 。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是 。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应1:400℃~756℃,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0
反应2:756℃~907℃,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH2 <0
Si(s) + 2ZnCl2(g) ΔH2 <0
反应3:907℃~1410℃,SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH3 <0
Si(s) + 2ZnCl2(g) ΔH3 <0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是 。
③ 已知Zn(l)==Zn(g) ΔH =" +116" KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
(6分)氮气其化合物是中学化学的基础知识,请你回答下列含氮化合物的有关问题。
(1)汽车尾气中含有氮氧化物,严重污染大气。NO和NO2是常见的氮氧化物,这两种氮氧化物中,呈红棕色的是;
(2)一氧化氮在常温下很容易与空气中的氧气化合,生成二氧化氮。该反应的化
学方程式为:;
(3)实验室常用NH3做“喷泉实验”,该实验说明NH3的溶解性是溶于水(填“极易”或“极难”)。
能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢所是最理想的清洁能源之一。已知反应:2H2+O2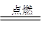 2H2O,试回答下列问题。
2H2O,试回答下列问题。
(1)该反应为反应(填“吸热”或“放热”);
(2)当生成18gH2O时,H2O的物质的量是(填字母代号)。
A.1mol B.1mol/L C.1g/mol
某待测液中可能含有Al3+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解。实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断:
该待测液中一定含有的阳离子是,
一定没有的阳离子是。还有一种阳离子没有检验,检验这种离子的
实验方法是(填写实验名称),现象是
。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显价,A的电负性B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是。
| 共价键 |
C-C |
C-N |
C-S |
| 键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),其中3种离子晶体的晶格能数据如下表: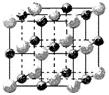
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。
(5)某配合物的分子结构如右图所示,其分子内不含有(填序号)。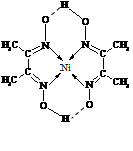
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为▲。(填字母)
A.用冰水混合物B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因▲,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应▲。
表1不同pH下二氧化锗的溶解率
| pH |
4 |
5 |
6 |
7 |
8 |
9 |
| 溶解率/% |
47.60 |
32.53 |
11.19 |
5.27 |
1.96 |
8.85 |