二氯化硫(SCl2)熔点—78oC,沸点59 oC,密度1.638g/cm3,遇水易分解,以下是由氯气与硫反应合成二氯化硫的实验装置,其中F中装有无水CaCl2固体。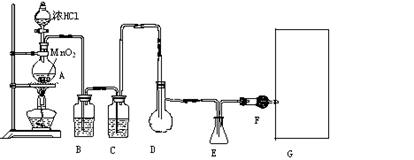
试回答下列问题:
(1)装置A中发生反应的化学方程式为: 
(2)装置C中盛放的试剂是 ,装置F的作用为
(3)实验开始前先排尽系统中空气,此做法目的是
再向D中放入一定量的硫粉,加热使之融化,然后摇动烧瓶使硫附着在烧瓶内壁形成一薄层膜,这样做的目的是
(4)实验时,如何防止E中液体挥发
(5)画出虚线框内与F连接的仪器,并指出其中盛装试剂名称,以完善该实验装置
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O===NH4Cl+NaHCO3(晶体),
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。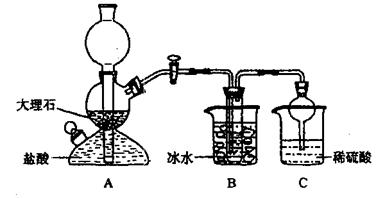
(1)A装置中所发生反应的离子方程式为。
C装置中稀硫酸的作用为。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 温度 溶解度 盐 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
参照表中数据,请分析B装置中使用冰水的目的是。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指寻教师指出应在装置之间(填写字母)连接一个盛有的洗气装置,其作用是。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为。
(14分)
根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)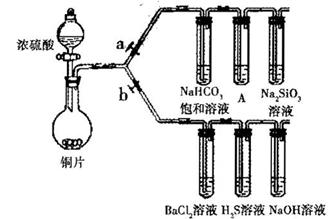
(1)验证碳、硅非金属性的相对强弱。(巳知酸性:亚硫酸 >碳酸)
①连接仪器. ________、加药品后,打开a关闭b,然后滴入滚硫酸,加热
②铜与浓硫酸反应的化学方程式是________________装置A屮的试剂是________
③能说明碳的非金属性比硅强的实验现象是:________
(2)验证 SO,的氧化性.、还原性和酸性氧化物的通性。
①打开b,关闭a。
②H2S溶液中宥浅黄色浑浊出现,化学方程式是:_____
③BaCl2溶液中无叨诚现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填人下表相应位置
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
写出其中SO2 显示 还原性并生成沉淀的离子方程式_________
还原性并生成沉淀的离子方程式_________
(14分)已知硝酸锏溶液颜色为蓝色.某学校化学课外小组同学们在做铜与浓硝酸、稀硝酸反应的实验中,发现铜和浓硝酸反应后溶液为绿色旦有红棕色气体产生,而铜和稀硝酸反应后溶液为蓝色,产生无色气体.为弄清反应后溶液颜色出现差异的原因,他们进行了实验探究.
[实验]在两支试管中各放入一小块等质量的铜片,分别加人等体积的浓HN03(14 mol •
L-1)和稀HN03(4mol . L-1 ), 立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1) Cu与浓HNO3反应的离子方程式________________________________
(2) 用蘸有NaOH的棉花封住试管口的原因________________
已知NO2与NaOH溶液反应中,其中NO2的还原产物是亚硝酸盐(NO2-)
写出反应的化学反应式________________________,
[提出假设]假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
[设计实验方案,验证假设]
(3) 上述实验________(“能”或“不能”)证明假设一不成立,原因________________
(4) 甲同学设计实验验证假设二,请帮他完成下表中内容(提示:NO3-在不同条件下的还咬产物较复杂,有时难以观察到气体产生)
[分析推理】
(5)铜和稀硝酸反应后溶液为蓝色的原理________________
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
催化剂 |
|
| ① |
10ml2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_ 。
(2)实验①和②的目的是__________________________________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是 。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。
分析上图能够得出的实验结论是。
(14分)
实验室用下图所示装置制备溴苯,并验证该反应是取代反应。 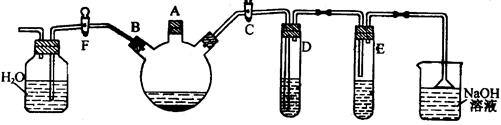
(1) 关闭F活塞,打开C活塞,在装有少量苯的三颈瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,则三颈瓶中发生反应的化学方程式为: 。
(2) D试管内装的是 ,其作用是 。
(3) E试管内装的是 ,E试管内出现的现象为 。
(4) 待三口烧瓶中的反应即将结束时(此时气体明显减少),打开F活塞,关闭C活塞,可以看到的现象是 。
(5) 上一步得到粗溴苯后,要用如下操作精制:a蒸馏; b水洗; c用干燥剂干燥; d 10%NaOH溶液洗涤; e水洗,正确的操作顺序是 。