Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
PH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
|
|
|
|
| ③ |
|
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p-CP的浓度随时间变化的关系如下图。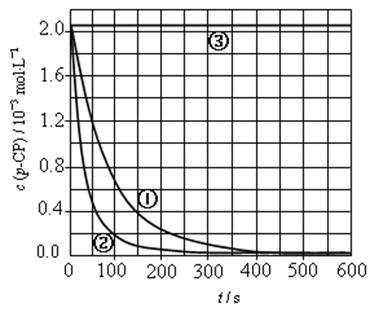
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
V(p-CP)= mol·L-1·s-1
[解释与结论](3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
(4)实验③得出的结论是:PH等于10时, 。
[思考与交流](5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
1,2—二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂在实验室中可以用下图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。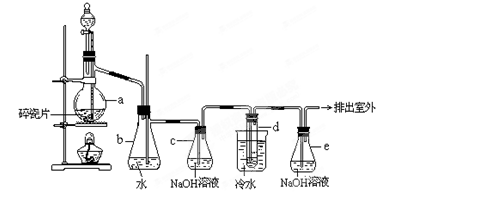
填写下列空白:
(1) 写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
_________________________________;_________________________________
(2) 安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象______________________________。
(3) 容器c中NaOH溶液的作用是________________________________。
(4) 某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因:
① ___________________________________________________________;
② ___________________________________________________________
实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液。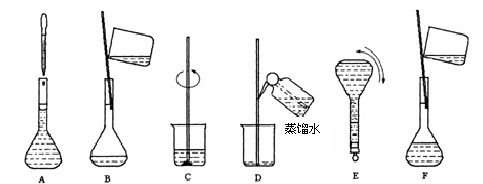
(1)需称量___________g烧碱,应放在_____________(填仪器名称)中称量
(2)配制过程中,不需要的仪器(填写代号)____________________
a、烧杯 b、量筒 c、玻璃棒 d、1000mL容量瓶 e、漏斗 f、胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器是____________,___________,________。
(4)步骤B通常称为转移,步骤A通常称为
(5)将上述实验步骤A到F按实验过程先后次序排列
(6)在容量瓶中确定溶液体积的过程中,最后加入少量水的操作是______________________
有一种工业废水,已知其中含有大量的FeSO4,少量的Ag+和Na+,以及部分污泥。现设计了一个既经济又合理的方法以回收金属银、硫酸亚铁。以下列出实验步骤,试说明每一步骤的目的(不必写化学方程式)。
(1)过滤
(2)滤液中加入过量铁粉
(3)过滤
(4)将混有铁粉的Ag用稀硫酸处理,
(5)过滤
(6)将第(3)和(5)步的滤液合并,蒸发浓缩,冷却,
(7)过滤,
选择下列实验方法分离物质,将分离方法的序号填在横线上
A 萃取分液法 B 结晶法 C 分液法 D 蒸馏法 E 过滤法 F 升华
①_____分离饱和食盐水与沙子的混合物。
②_____分离水和汽油的混合物。
③______分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
④_____从碘的水溶液里提取碘。
⑤______从硝酸钾和氯化钠的混合液中获得硝酸钾。
⑥分离氯化钠晶体和碘单质。
(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该同学在操作时的一个错误是_____,烧杯的实际质量为___g.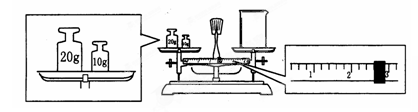
(2)指出下面实验中存在的二个错误:
A.需配制250 mL 0.2 mol/LNaCl溶液,题右图是该同学转移溶液的示意图。
、