高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下: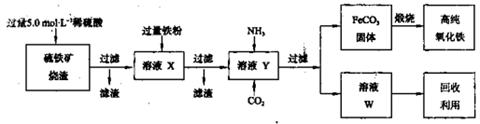
回答下列问题: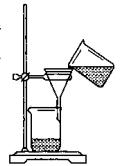 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2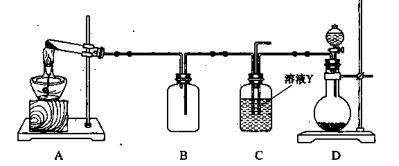
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
| A.MnO2与浓盐酸反应制备Cl2 |
| B.Cu与浓硫酸反应生成SO2 |
| C.由KMnO4分解制O2 |
| D.乙醇与乙酸反应制备乙酸乙酯 |
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
实验室中可以用下列一些装置连接起来制纯净的CO2气体,并测定其分子量(用含少量FeS的大理石和盐酸制备CO2气体)。
实验步骤如下:
(1)将橡皮塞B塞在A烧瓶上,并用皮筋套在烧瓶的瓶劲处以标记橡皮塞入瓶颈的深度,准确称量其质量为w1。
(2)连接制取和净化气体的装置,其连接顺序是:_____接______,______接_____,_____接_____,______接______。
(3)将导管G插入烧瓶A中用向_____(上/下)排气法收集CO2并检验CO2是否已经充满,检验CO2已充满的方法是______,用橡皮塞塞好烧瓶瓶口称其质量为w2。
(4)将烧瓶口瓶塞取下向烧瓶注水至标记线,再将水倒入量筒测量水的体积为VmL。
(5)记录当时实验时室温为t℃和压强为p帕。(R取8.314Pa·L·K-1·mol-1)
回答下列问题:
①计算CO2分子量的算式是________。
②若不将气体净化,所测定的CO2分子量的数值将_____(偏高/偏低),其原因是_____。
某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
| 实验操作 |
实验现象 |
|
| 步骤1 |
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 |
有少量气泡产生,溶液的黄绿色褪去 |
| 步骤2 |
将第一份滤液与稀盐酸混合 |
产生大量气泡 |
| 步骤3 |
将第二份滤液加热 |
溶液变浑浊,且有大量无色气体产生 |
⑴步骤1过滤的目的是__________________________________________。
⑵步骤2、步骤3的实验目的都是;为达到该实验目的,还可以采取的方法是。
⑶请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:。
要使含Ba2+,Al3+,Fe3+,Ag+的硝酸盐溶液进行分离,并制成各自离子的硝酸盐。今有人设计如下分离方法,请在下图中的空格内填写适当物质的化学式或离子符合,在题后填写各步所加试剂(供选用的试剂有:NaOH溶液、氨水、碳酸钠溶液、硝酸和葡萄糖溶液。)
①A______②B_____③C_____④D____⑤E______。
某无色溶液可能含有下列钠盐中的几种:
| A.氯化钠; | B.硫化钠; | C.亚硫酸钠; | D.硫代硫酸钠;(E)硫酸钠;(F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清石灰水变浑浊,不能使品红溶液褪色。根据上述实验现象回答下列问题: |
(1)不能使品红试液褪色,说明该气体中不含_____(填化学式)。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母):
第一种情况是__________________________________;
第二种情况是__________________________________;
第三种情况是__________________________________;
第四种情况是__________________________________。
(可不填满,也可补充)
(10分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下装置(图1),请回答下列问题:
(1)写出Na与H2O反应的化学方程式_____________________________________。
(2)在点燃H2前必须先进行_____________________________________________,
方法是 _______________________________________________________。
(3)实验小组在点燃用图1装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是________________________________________________________________________。
(4)实验小组查阅钠、苯、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进(如图2),在改进后的实验中H2的生成速率减慢。原因是________________________________________________________________________。