(6分)由铜片、锌片和200 mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:
(1)反应中消耗的锌的质量是多少?(Zn:65)
(2)有多少个电子通过了导线?
(3)原稀H2SO4的物质的量浓度是多少?
含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+ 10Al + 18H2O=3N2↑+ 10Al(OH)3 + 6OH-。
+ 6OH-。
某化学兴趣小组的同学经过探究发现还有两条途径:
(1)金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。金属镁是从海水中提取的MgCl2通过电解制得的。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水多少kg?
(2)甲醇加人含NO3-的废水中也可消除氮的污染,其在一种微生物作用下发生反应:
6NO3- +6H+ +5CH3OH → 3N2↑ + 5CO2 ↑+ 13H2O
若某废水用上述方法处理时, NO3—→N2的 转化率为a%,那么每天处理此含NO3-为b g/L的废水V m3(密度1g/cm3)。需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
转化率为a%,那么每天处理此含NO3-为b g/L的废水V m3(密度1g/cm3)。需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
苹果酸是一种浓缩饮料的主要酸性物质。分离提纯后的化学分析如下:
(1)元素分析证明该酸只含C、H、O三种元素,其中C、H、O的质量比为24∶3∶40;该酸蒸气的密度是同温同压下氢气密度的67倍。
(2)0.l mol该酸与足量NaHCO3反应放出4.48 L CO2,与足量金属Na反应放出3.36 L H2(气体体积均已折算为标准状况下的体积)。
(3)该酸分子结构中没有支链。通过计算求苹果酸的分子式及结构简式。
硝酸是一种重要的 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N2的转化率
,则N2的转化率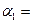 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则
 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
(4分)稀硝酸和铜反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
如果有3.2克铜和硝酸恰好完全反应,试计算:
(1)在标准状况下产生气体的体积是多少?
(2)将所得溶液加水配成200mL溶液,则溶液的物质的量浓度是多少?
现将0.1mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8g,后者增重22g(假定气体全部吸收)。试通过计算推断该烃的分子式