为测定某Na2SO3样品(含少量Na2SO4杂质)的纯度,实验室按以下步骤进行;①称取ag样品,置于烧杯中;②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
| 方法一 |
方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 |
④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。 |
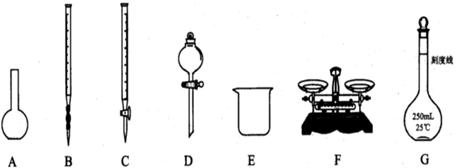
请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和 (填字母);
(2)在方法一④中加入过量稀盐酸的目的是 ;
(3)在方法一测定得到Na2SO3样品的纯度是 (列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂 (填“是”或“否”),请简述理由 ;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果
(填“偏高”、“偏低”、“无影响”)。
(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有
①____________________________________________________________________________;
②____________________________________________________________________________。
用离子方程式表示产生上述现象的原因___________________________________________
____________________________________________________________________________。
(2)在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是________。
| A.磷 | B.硫 | C.镁 | D.铜 |
(3)向物质的量之和为0.1 mol的FeCl3、AlCl3的混合溶液中加入90 mL4 mol·L-1的NaOH溶液,使其充分反应。假设原溶液中Al3+物质的量与Fe3+和Al3+总物质的量之比为x。
①当x=0.4时,溶液中产生的沉淀是_____________,其物质的量为_____________。
②当沉淀只有Fe(OH)3时,x的取值范围为_____________。
10分)(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,正确的操作是 __________。纯碱溶液呈碱性的原因(用离子方程式表式)是__________,你认为该溶液pH的范围一定介于__________之间。
(2)为探究纯碱溶液呈碱性是由 引起的,请设计一个简单的实验方案。
引起的,请设计一个简单的实验方案。
有A、B两种可溶性盐:(1)在A、B两溶液中分别加入碱溶液,A无变化、B产生白色沉淀F;(2)在A、B两溶液中分别加入硫酸,A产生白色沉淀C后又消失,B产生不溶于酸的白色沉淀D和无色无味、能使澄清的石灰水变浑浊的气体E;(3)将E通入A中也产生白色沉淀C;(4)A溶液焰色反应呈黄色。按要求完成:
①写出下列物质的化学式:C__________,E__________。
②完成下列过程的离子方程式:A+硫酸____________________;B+硫酸___________________。
硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80 ℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请完成下列问题:
(1)实验步骤①的目的是___________________,加热的作用是
_________________________。
(2)实验步骤②明显不合理,理由是
________________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_________________;
__________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
| 温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
| 溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
| 析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
如图所示,横坐标表示通入气体或加入试剂的体积,纵坐标表示产生沉淀的物质的量。适合下列各种情况的分别填入该题后(填图的字母代码)。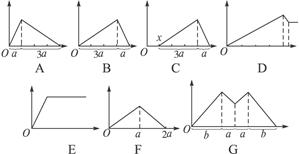
(1)向石灰水中通入二氧化碳_________。
(2)向氯化铝溶液中滴入NaOH溶液_________。
(3)向偏铝酸钠溶液中加入稀盐酸_________。
(4)向盐酸和氯化铝混合溶液中逐滴加入氢氧化钠溶液_________。
(5)向MgCl2和AlCl3混合液中加入过量的NaOH溶液_________。
(6)向MgCl2和AlCl3混合液中先加NaOH溶液后,至沉淀不再溶解,加HCl溶液_________。
(7)向AlCl3溶液中加氨水_________。
(8)向NaAlO2溶液中通入CO2气体_________。
(9)向KAl(SO4)2中滴加Ba(OH)2_________。
(10)向Al2(SO4)3中滴加NaAlO2溶液_________。