在含有Cl-.Br-.I- 的溶液中,已知其浓度均为0.1 mol/L,而AgCl.AgBr.AgI的浓度积(mol2/L2)分别为:1.6×10-10.4.1×10-15.1.5×10-16。若向混合溶液中逐滴加入AgNO3溶液并充分搅拌时,首先析出的沉淀是_______________,最后析出的沉淀是_________;当AgBr沉淀开始析出时,溶液
的溶液中,已知其浓度均为0.1 mol/L,而AgCl.AgBr.AgI的浓度积(mol2/L2)分别为:1.6×10-10.4.1×10-15.1.5×10-16。若向混合溶液中逐滴加入AgNO3溶液并充分搅拌时,首先析出的沉淀是_______________,最后析出的沉淀是_________;当AgBr沉淀开始析出时,溶液 中Ag+的浓度是___________________
中Ag+的浓度是___________________
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素。请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是和,相同条件下两者在水中的溶解度较大的是(写分子式),理由是;
(2)Q的元素符号是,它的核外电子排布式为,在形成化合物时它的最高化合价为;
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键。
(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,其电子式为;其晶体的最小结构单元如图所示,经实验测得FH5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为cm。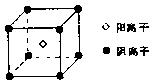
有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:
请填写下列空格:
(1)甲的浓溶液与一种黑色粉末共热可得A,该反应的离子方程式为:
__________________________________________________________。
(2)写出下列化学用语:用电子式表示乙分子的形成过程_______________,
戊分子的结构式是__________,甲和丙反应产物的电子式 __________。
(3)写出下列反应的化学方程式:
丙+丁→D + 乙:_____________;A+丙→D + 甲:__________________
已知硝酸与金属反应时,在不同条件下有不同的还原产物,甚至在同一反应中可同时得到多种还原产物。现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质,(1)请利用其中五种物质组成一个完整的化学反应,写出该化学反应方程式;
(2)上述所写反应中,硝酸表现出的化学性质是,被还原的元素是。
(3)若六种物质组成一个完整的化学反应,则反应中的还原产物是(填化学式),若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为。
一定温度下,将2mol A和2mol B两种气体混合于体积为2 L的某恒容的密闭容器中,发生如下反应:3A(g)+B(g) x C(g)+2D(g),
x C(g)+2D(g), H <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
H <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)X的值等于,
(2)该反应的化学平衡常数K=,升高温度时K值将
(填“增大”、“减小”、“不变”)
(3)A物质的转化率为。
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为mol;达新平衡时,A的物质的量为n(A)= mol。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为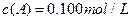 、
、 及
及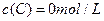 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②____________;
③_______________;
(2)实验②平衡时B的转化率为________;实验③平衡时C的浓度为__________;
(3)该反应的 _______0,判断其理由是________________________________;
_______0,判断其理由是________________________________;
(4)该反应进行到4.0min时的平均反应速率:
实验②: =_______________________;实验③:
=_______________________;实验③: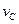 =____________________。
=____________________。