根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式 ▲ ;
(2)Be(OH)2与Mg(OH)2可用__▲___试剂鉴别,其反应离子方程式为 ▲ 。
(3)Li和Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是__▲____;同时还有少量 ▲ 生成。
(7分) 某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 ml 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式。
(2)实验②中化学反应转移电子的物质的量是。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是。
(10分)下图中A~J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A~E和F~J中分别含有同一种元素。反应E→A+O2的条件未标出。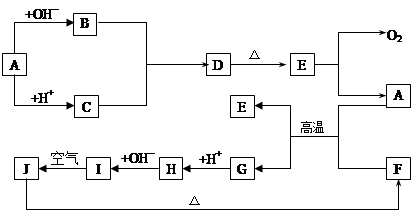
请填写下列空白:
(1)化合物H中的阳离子是;D的化学式为。
(2)A生成B反应的离子方程式是。
(3)A和F的混合物发生反应的化学方程式是。
(4)写出B与C生成D的离子方程式。
(5)I→J反应的化学方程式是。
(8分) 某无色透明的溶液可能含有K+、Cu2+、Ca2+、Br—、SO42—、CO32—、Cl—中的几种,进行如下实验:
(1)滴加氯化钡溶液,有白色沉淀产生。将沉淀滤出,并将滤液分为两份,产生的沉淀可部分溶于稀硝酸。
(2)取一份滤液,向其中加入氯水并加入四氯化碳,振荡后静置,四氯化碳层呈橙色。
(3)向另一份滤液中加入硝酸银溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
(4)取原溶液做焰色实验,透过蓝色钴玻璃观察到紫色。
试判断:该溶液中一定有离子,肯定没有离子,可能有离子。要进一步确定可能存在的离子,还需要做的实验是
氮化硅(Si3N4)是一种重要的结构陶瓷材料,属于新型功能性硅酸盐产品,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300 ℃时反应获得。
(1)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式______________________________________________。
(2)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为__________
(3)沸石是一种含结晶水的,具有多孔结构的铝硅酸盐,化学式为Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示为。
(4)盛装氢氧化钠溶液的试剂瓶不能用玻璃塞的原因是:(用离子方程式表示).
(11分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。
在X极附近观察到的现象是。
②Y电极上的电极反应式为,
检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应式是。
②Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
①该电解槽的阳极反应式是____________________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因
③除去杂质后的氢氧化钾溶液从溶液出口_________________(填写“A”或“B”)导出