已知X、Y、Z三种短周期主族元素在元素周期表中的位置关系如图所示。
| Z |
|
| Y |
X |
请回答:(1)三种元素中原子半径最大的是 (填X、Y或Z)
(2)若X的单质是黄绿色气体,则X和Y的最高价氧化物对应的水化物的酸性强弱顺序为 (用化学式表示),和X同主族元素氢化物中熔沸点最高的是 (用化学式表示),原因是 ;X单质溶于水生成物之一具有漂白性,写出该物质结构式 。
(3)若X的单质与强酸、强碱溶液反应均能放出氢气,则元素X在周期表中的位置 写出X单质和烧碱溶液反应的离子方程式
探究X和Y两种元素金属性强弱的实验方法是 。
(4)若Y的氧化物是制造光导纤维的材料,则Y元素的名称是 ,
工业上利用单质Z和Y的氧化物高温下反应,生成一种具有空间立体网状结构的化合物,另一种生成物是有毒气体,写出反应化学方程式 。
分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式。说明:①不考虑同一碳原子上连两个羟基;②乙炔、苯等分子中同类原子化学环境相同,丙烷、丁烷等分子中同类原子化学环境有两种。
(1)甲分子中没有甲基,且1 mol甲与足量金属Na反应生成1 mol H2。若甲还能与NaHCO3溶液反应,则甲的结构简式为__________________________;若甲还能发生银镜反应,则甲的结构简式为_________________________。
(2)乙分子中所有同类原子的化学环境相同,且不与金属Na反应,则乙结构简式为:_______。
(3)丙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且丙与金属Na不反应,则丙结构简式为__________________________________________。
硫单质通常是一种淡黄色固体,它的蒸气有橙色、无色、红棕色三种,它们都是硫的单质,但每个分子中硫原子个数不同,可用Sx表示。对这三种蒸气的测定结果如下:
(1)橙色蒸气的密度折算成标准状况后是11.34 g·L-1,则它的化学式为________________。
(2)红棕色蒸气的质量是相同状况下同体积空气的6.62倍,则它的化学式为_____________。
(3)无色蒸气是相同状况下氢气密度的64倍,则它的化学式为______________________。
(4)以上三种蒸气都属于硫单质的____________________。
可以从以下角度判断氯元素和硫元素非金属性的强弱:
(1)在元素周期表中,氯元素和硫元素的相对位置是__________________________,根据____________________________规律来判断氯元素和硫元素非金属性的强弱。
(2)二者气态氢化物中______________(填化学式)更易分解,由此可判断氯元素和硫元素非金属性的强弱。
(3)向硫化氢溶液中通入氯气,溶液变浑浊,反应的化学方程式为__________________,说明氯元素的非金属性比硫元素________________(填“强”或“弱”)。
(4)氯气和硫分别与铁形成化合物的化学式为________________和________________,据此也可判断氯元素和硫元素非金属性的强弱。
根据下表,用化学式或元素符号完成下列问题:
| O |
F |
| S |
Cl |
| Se |
Br |
| Te |
I |
(1)非金属性最强的元素是_________________。
(2)还原性最强的离子是________________。
(3)H2Te的稳定性比HI(填“强”或“弱”)______________。
(4)已知:2F2+2H2O====4HF+O2,Cl2+H2S====2HCl+S↓,请完成下列化学方程式:
Br2+H2Se====________________。I2+H2Te====______________。
针对以下A—D四个涉及H2O2的反应(未配平):
A.Na2O2+HCl H2O2+NaCl H2O2+NaCl |
B.Ag2O+H2O2 Ag+O2+H2O Ag+O2+H2O |
C.H2O2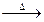 H2O+O2 H2O+O2 |
D.H2O2+Cr2(SO4)3+KOH K2SO4+K2CrO4+H2O K2SO4+K2CrO4+H2O |
请完成下列问题:
(1)H2O2仅表现氧化性的反应是_______________(填编号,下同),并配平此化学反应方程式:______________________。
(2)H2O2既表现氧化性又表现还原性的反应是___________。
(3)H2O2仅表现弱酸性的反应是___________,其理由为__________________________。