工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: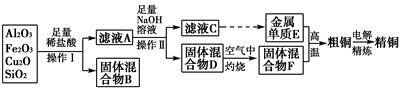
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为____________________________________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为__________________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿(主要成份:CuO ZnO)的方案,实现废物综合利用,方案如下图所示。
请回答下列问题:
(1)操作1的名称是:
(2)向溶液A中加入Fe粉发生的主要的反应离子方程式为:、。
(3)向溶液B中加入物质X的目的是,物质X可用下列物质中的。(填字母)
| A.KMnO4 | B.O2 | C.H2O2 | D.NaOH |
(4)向溶液B中加入氨水的目的是调节溶液的pH,pH应控制在范围之间。
(5)溶液D中主要溶质的化学式是。
(6)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”)。
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。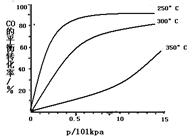
(1)NO2可用水吸收,相应的化学反应方程式为 。
利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol
2NO2(g) ΔH="-113.0" kJ·mol
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一
试回答下列问题:
(1)化合物I与CH3CHO所发生的有机反应类型是
(2)化合物III在银氨溶液中发生反应化学方程式
(3)下列说法正确的是(双选)
| A.化合物I遇氯化铁溶液呈紫色 |
| B.化合物II能与NaHCO3溶液反应 |
| C.1mol化合物IV完全燃烧消耗9.5molO2 |
| D.1mol化合物III能与3 mol H2反应 |
(4)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:
①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。
请写出化合物X的结构简式(写出两种)
(5)有机物R(如图)经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为。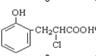
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2SO4溶解A12O3的离子方程式是
将KMnO4 氧化Fe2+的离子方程式补充完整: MnO4-+□Fe2++□ =
MnO4-+□Fe2++□ = Mn2++□Fe3+ +□
Mn2++□Fe3+ +□
上式中氧化剂是 ,氧化产物是 。
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
②Ⅳ 中加入MnSO4的目的是 。
有几个实验小组的同学,利用下图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质。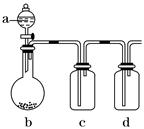
请你回答以下各组同学在交流实验设计方案中提出的问题:
Ⅰ.(1)若a:浓盐酸;b:高锰酸钾(其氧化性比二氧化锰强很多);c:红色鲜花瓣。在实验过程中c中的现象_____________________________________________________________。
d装置中盛放药品的作用是______________________________,请写出d中反应的离子方程式: ___________________________________________________________________。
(2)若a:稀盐酸;b:贝壳粉;c:饱和碳酸钠溶液;d:饱和Na2SiO3溶液。在实验过
程中,c中出现的现象是____________________。d中现象是____________,这说明
________________________________________________________________________。
Ⅱ.你认为四组同学在制取气体之前都应进行的操作是________________。你还可以利用此装置的a和b两部分制取的气体有(只写一种)_________________。