A B C D E是前四周期元素,且原子序数依次增大。A的原子核中只有一个质子;B原子外围电子排布nS n nP n ;D原子核外有2个电子层,S轨道电子总数和P轨道电子总数相等;E 2+ 的M能层上各能级的电子数之比为1:3:3 请回答下列问题:
(1)E原子基态电子排布式
(2)这五种元素中电负性最大的是 (填元素符号,下同)第一电离能最小的是
(3)化合物EBC2中阴离子是BC22-,和BC2 2- 互为等电子体的分子有C2D和 ,由此可知BC2 2- 的空间构型是 。
(4)由A C两元素形成一种10电子分子X,写出X的电子式
X可与多种金属离子形成配合物。钴有两种化学式均为Co(X)5BrSO4的配合物,且配位数均为6,则它们分别溶于水时电离出的阳离子的化学式可能是 和 ;
(5)A C两元素还能形成一种离子化合物,写出该化合物化学式 ;你认为该化合物中除了离子键外还存在化学键是 ;该化合物溶于水有气体产生,写出反应化学方程式
(共12分)某盐X由非金属元素组成,不稳定加热时分解,生成等物质的量的气态氢化物A和B。A、C、E、G、I含有同种元素,C为黄色固体单质。B、D、F、H、J含有同种元素,B可与 J反应生成盐。W是前四周期含有4个未成对电
J反应生成盐。W是前四周期含有4个未成对电 子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题:
子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题: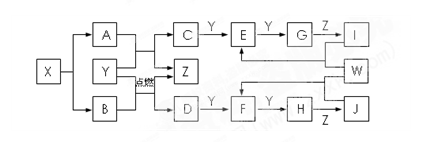
(1)X的化学式
(2)写出由E生成G的化学反应方程式
(3)写出反应B+Y →D+Z的化学方程式
(4)由E直接转换成I可以加入(填写两种属于不同类别的物质)。
(5)标况下,4.48LA与J的浓溶液反应转移1.6mole-,写出此反应的离子方程式。
(6)将1mol/L200mL I和1mol/L100mL J溶液混合,加入到含有0.5mol的W中,则产生气体的物质的量为
氯气在298K、100kPa 时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为;
(2)估算该反应的平衡常数(列计算式)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。
下表是元素周期表的一部分,用元素符号或化学式回答下列有关问题:

(1)写出下列元素符号:⑥ ________,⑨________。
(2)画出原子的结构示意图:② ________,⑤________。
(3)在这些元素中,最活泼的金属元素是________,最活泼 的非金属元素是________,二者形成的化合物的电子式为
的非金属元素是________,二者形成的化合物的电子式为
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________、具有两性的是。
一定条件下的可逆反应2NO2 (g)  N2O4 (g) △H=" -92.4kJ/mol" 达到化学平衡状态且其它条件不变时,
N2O4 (g) △H=" -92.4kJ/mol" 达到化学平衡状态且其它条件不变时,
(1)如果升高温度,平衡混合物的颜色;(变深、变浅)
(2)如果在体积固定的容器中加入一定量的二氧化氮,化学平衡向方向移动。
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: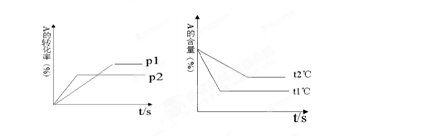
(1)压强 P1比P2(填大或小);
(2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);(4)正反应为反应。