同周期的X、Y、Z三种元素其最高价氧化物对应水化物均呈酸性,且 酸性强弱顺序为HZO4>H2YO4>H3XO4。则下列推断中,正确的是
酸性强弱顺序为HZO4>H2YO4>H3XO4。则下列推断中,正确的是
| A.单质的氧化性按X、Y、Z的顺序增强 |
| B.原子序数按X、Y、Z的顺序减小 |
| C.原子半径按X、Y、Z的顺序增大 |
| D.气态氢化物的稳定性按X、Y、Z的顺序减弱 |
神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验。火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为:S+3C+2KNO3=K2S+N2↑+3CO2↑。
①K2S的电子式为,CO2的结构式为。
②已知S和氯水反应会生成两种强酸,其离子方程式为。
③取黑火药爆炸后的残留固体,加水溶解过滤,得到滤液。写出检验此溶液中是否含有K+的实验操作方法。
(2)20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有麟(N2 H4)、液氢等。
①肼(N2 H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:。
②一种与N2 H4电子数相等的绿色氧化剂,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,化学方程式为:。
(3)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富。有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。写出其爆炸的化学方程式。
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。分析其组成,现进行如下实验:
①取l0mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲。
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生。
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0. 03 mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0. 224L(假设丙全部逸出),最后沉淀完全溶解。下列推断正确的是
| A.肯定有K+、Al3+、Mg2+、SO42- |
| B.肯定有K+、NH4+、Al3+、SO42- |
| C.肯定没有K+、HCO3-、MnO4- |
| D.肯定没有K+、NH4+、Cl- |
下列说法正确的是
| A.常温下某溶液中由水电离出的c(H+)=1×10-amol/L,若a<7时,则该溶液可能为NaHSO4溶液 |
| B.中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸) |
| C.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:②<③<① |
| D.已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol·L-1的AgNO3溶液和1×10-4 mol·L-1 K2Cr04溶液混合,会有Ag2CrO4沉淀产生 |
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融) 4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是
4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是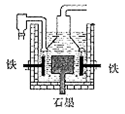
| A.电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-=Na |
| B.盖·吕萨克法制钠原理是嫡的增加带动了反应的进行 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:1 |
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
下列说法正确的是
A.按系统命名法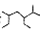 的名称为2一甲基一3,5一二乙基己烷 的名称为2一甲基一3,5一二乙基己烷 |
| B.用Na2 C03溶液能区分CH3COOH、CH3CH2OH,苯、硝基苯四种物质 |
| C.等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所耗氧气的量依次增加 |
| D.下列物质的沸点按由低到高顺序为:(CH3CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3<(CH3)2CHCH2CH3 |