下列关于化学反应限度的说法中错误的是
A.当一个可逆反应达到平衡状态时,就是这个反应所能 达到的 达到的 限度 限度 |
B.当一个可逆反应进行到平衡状态时,那么这个反应的正向反应速率和逆向反应速率相等 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 |
| D.化学反应的限度可以通过改变条件而改变 |
下列各组物质,按混合物、单质、化合物顺序排列的是
| A.烧碱、液态氧、碘酒 | B.空气、氮气、胆矾 |
| C.生石灰、白磷、熟石灰 | D.干冰、铁、氯化氢 |
用NA表示阿佛加德罗常数,下列说法正确的是
| A.22.4L H2的物质的量约为1mol |
| B.标准状况下,11.2L H2O的物质的量约为0.5 mol |
| C.1 L 1mol/L的MgCl2溶液中Cl-的物质的量浓度为2mol/L |
| D.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA |
下列微粒的电子式书写正确的是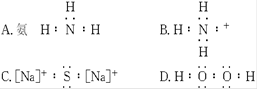
下列性质中,可以证明某化合物内一定存在离子键的是
| A.可溶于水 | B.具有较高的熔点 |
| C.水溶液能导电 | D.熔融状态能导电 |
AB、CD、EF均为1∶1型离子化合物,根据下列数据判断它们的熔点由高至低的顺序是
| AB |
CD |
EF |
|
| 离子电荷数 |
1 |
1 |
2 |
| 键长(10-10 m) |
2.31 |
3.18 |
2.10 |
A.CD>AB>EFB. AB>EF>CD
C.AB>CD>EF D.EF>AB>CD