已知四种元素A、B、C、D 为1到20号元素,且原子序数依次增大,A的核外电子数与其电子层数相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。请回答下列问题:
(1) C在周期表中的位置第 ______周期 ,第________族;
,第________族;
(2 ) 写出铜与稀HBO3溶液反应的离子反应方程式
) 写出铜与稀HBO3溶液反应的离子反应方程式
(3) A、B形成的化合物的结构式____ ;其中含有的化学键类型为________,用电子式表示该化合物形成过程 ___ _。
(4)写出D与C形成化合物的电子式____ ____。
血红素中含有C、O、N、Fe五种元素。回答下列问题:
⑴C、N、O、H四种元素中电负性最小的是(填元素符合),写出基态Fe原子的核外电子排布式。
⑵下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有,在右图的方框内用“→”标出Fe2+的配位键。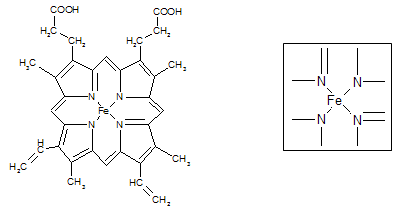
⑶NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑷N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是: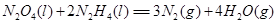
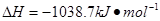
若该反应中有4mol N—H键断裂,则形成的 键有___________mol。
键有___________mol。
⑸根据等电子原理,写出CN—的电子式, 1 mol O22+中含有的π键数目为。
⑹铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为。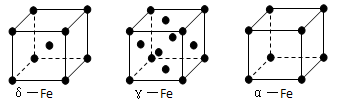
15分)普通纸张的成分是纤维素,在早期的纸张生产中,常采用纸表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______。为防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______。
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是______。
②喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾,钛白粉的一种工业制法是以钛铁矿主要成分(FeTiO3)为原料按下过程进行的,请完成下列化学方程式
(Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应。10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为。
(2)下图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式。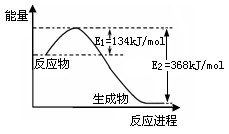
(3)NH3(g)燃烧的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)==2H2O(l) △H=" -483.6" kJ/mol
N2(g)+2O2(g)==2NO2 (g) △H="+67.8" kJ/mol
N2(g)+3H2(g)==2NH3 (g) △H="-92.0" kJ/mol
请计算NH3 (g)的燃烧热。
| 温度 |
平衡浓度/ (molL-1) |
|
| c(NH3) |
c(CO2) |
|
| T1 |
0.1 |
|
| T2 |
0.1 |
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s) 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
(Ⅱ)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
含量/(mgL-1) |
成分 |
含量/(mgL-1) |
| Cl- |
18980 |
Ca2+ |
400 |
| Na+ |
10560 |
HCO3- |
142 |
| SO42- |
2560 |
Br- |
64 |
| Mg2+ |
1272 |
 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
(1)阳极主要电极反应式是。
(2)在阴极附近产生少量白色沉淀,其成分有和CaCO3,生成CaCO3的离子方程
式是。
(3)淡水的出口为(填“a”、“b”或“c”)。
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是。
(2)下列说法正确的是。
a.酸性:H2CO3>H2SiO3
b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是,滤渣和NaOH溶液反应的离子方程式是。
(4)该矿石和1 molL-1HNO3反应的离子方程式。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 molL-1 HNO3的体积为L。
(14分)低碳生活(low-carbon life)是一种时尚的生活理念,倡导人们降碳节能、有效幵发利用CO2。
(1) 若用如图装置,以CO2和H2为原料制备甲醇,发生反应为 。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。
。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。
(2) 工业上可在6500C浮石银催化作用下用甲醇制备甲醛。当 时,制备反应分两步进行,其中一步是
时,制备反应分两步进行,其中一步是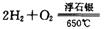
 ,则另一步是____________ (写化学方程式)。
,则另一步是____________ (写化学方程式)。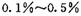 的HCHO可用于杀菌消毒,其原因是________。
的HCHO可用于杀菌消毒,其原因是________。
(3) 最近有人利用ZrO2作为固体电解质制造出了常温下的甲醇一空气燃料电池。当原电池中有0. 5 mol甲醇消耗时,产生最大电能为360. 0 kJ。则负极消耗O2—的物质的量为________mol;若该燃料电池所产生的最大电能与甲醇常温下燃烧所释放的全部能量之比为9: 10,则CH3OH燃烧的热化学方程式为________;在O2不足时原电池会发生负极区固体电解质堵塞,导致堵塞的物质是________。