氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________。 (2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是 。
(3)已知:
| |
CH4 |
SiH4 |
NH3 |
PH3 |
| 沸点(K) |
101.7[ |
161.2 |
239.7 |
185.4 |
| 分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是
_____________________________________________________________。
② CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是
___________________________________________________________。
化工原料X可通过以下流程合成: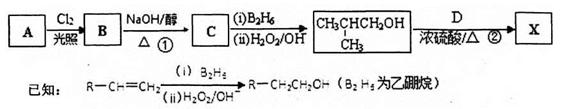
(1)烃A的相对分子质量是58,则A的分子式是;B是A的一氯取代产物,其分子的核磁共振氢谱只有一种峰,写出B的名称(系统命名)。
(2)反应①的化学方程式为
(3)分子D (C9H8O2)的结构中含有苯环,且苯环上一氯代物只有两种,D能与NaHCO3溶液反应生成CO2,反应②的化学方程式为。
(4)写出两种符合下列条件的D的同分异构体:_______、_______(结构简式)。
a.遇FeC3溶液显紫色b.能发生银镜反应c.苯环上有两个取代基
(5)下列关于X性质的说法中,正确的有_______。
a.易溶于水,沸点较低
b.能发生加成反应和取代反应
c.能使酸性高锰酸钾溶液褪色
d.1 mol X在溶液中最多能和2 mol NaOH反应
A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如下图所示。
(1)A、B、C、D四种元素中第一电离能最小的是(填元素名称),其基态原子核外电子排布式是,
(2)D、E的最高价氧化物的水化物中,酸性较强的是(写化学式)。
D的氢化物沸点比A的氢化物沸点(填“高”或“低”)。
(3)化合物CA2的晶体类型是______,CA2与B最髙价氧化物的水化物溶液发生反应的离子方程式是_______
(4)在298K、101.3kPa下,1.6gD单质在足量的氧气中燃烧,放出14.85kJ热量,该反应的热化学方程式是______________
某些有机化合物之间具有如下转化关系: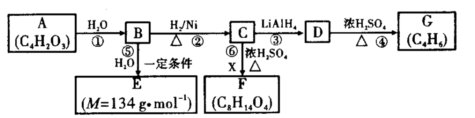
其中:A是一种五元环状化合物,其分子中只有一种化学环境的氢原子;F核磁共振氢谱显示有三种不同化学环境的氢原子,且峰面积之比为2:2:3;G是合成顺丁橡胶的主要原料。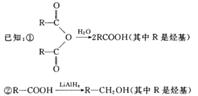
(1)A的结构简式是。
(2)B中所含官能团的名称是。
(3)写出反应类型:③,④
(4)⑥的化学方程式为
(5)E在一定条件下能够发生缩聚反应,写出链节是由四个原子组成的高聚物的结构简式。有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构简式可能有种。
A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
| 元素 |
有关性质或结构信息 |
| A |
负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B |
B原子得到一个电子后3p轨道全充满 |
| C |
C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D |
D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E |
E元素的核电荷数等于A原子和B元素氢化物的核电荷数之和 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B)I1(Y)。
(2)E元素原子的核外电子排布式为
(3)盐X的水溶液呈(填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性(填“强”或“弱”)。
(4)C单质分子中σ键和π键的个数比为,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:。写出该阳离子与硫的氢化物的水溶液反应的离子方程式:
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、酒类等行业。DBP是增塑剂的一种,可由下列路线合成。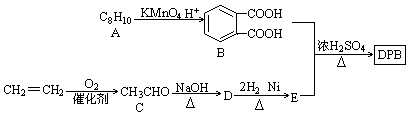
已知以下信息:
①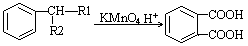
②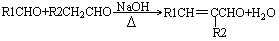
(—R1、一R2表示氢原子或烃基)
(1)A的结构简式,D→E的反应类型。
(2)B的名称是,D中含有的官能团名称是。
(3)由B和E合成DBP的化学方程式。
(4)写出同时符合下列条件的B的所有同分异构体结构简式
①能和NaHCO3溶液反应生成CO2③能使FeC13溶液发生显色反应
②能发生银镜反应④苯环上含碳基团处于对位