已知T℃、p kPa时,往容积可变的密闭容器中充入2 mol X和1 mol Y,此时容积为VL。保持恒温恒压,发生反应:2X(气)+Y(气)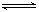 2Z(气),达到平衡时,平衡气中Z的体积分数为0.4。试回答下列有关问题:
2Z(气),达到平衡时,平衡气中Z的体积分数为0.4。试回答下列有关问题:
(1)使温度和压强在上述条件下恒定不变,再往上述密闭容器内充入4molZ,则反应达到平衡时,容器的容积为 ,平衡气中Z的体积分数为 。
(2)若另选一个容积固定不变的密闭容器,仍控制温度为T℃,使3molX和1.5molY反应,达到平衡状态时,平衡气中Z的体积分数仍为0.4,则该密闭容器的容积为 。
现将0.1mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8g,后者增重22g(假定气体全部吸收)。试通过计算推断该烃的分子式
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式
________________________________________________
__________________________________________。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。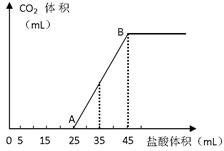
市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
| 分装日期 |
|
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,
KIO +5KI+3H2SO4= 3K2SO4+ 3
+5KI+3H2SO4= 3K2SO4+ 3 + 3H2O
+ 3H2O
上述反应生成的 可用四氯化碳检验:确认有
可用四氯化碳检验:确认有 生成的现象是___________________
生成的现象是___________________
利用 稀溶液,将
稀溶液,将 还原,可从碘的四氯化碳溶液中回收四氯化碳。
还原,可从碘的四氯化碳溶液中回收四氯化碳。 稀溶液与
稀溶液与 反应的离子方程式为。
反应的离子方程式为。
(2)已知: 某学生测定食用精制盐的碘含量,其步骤为:
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO 与KI反应完全;
与KI反应完全;
c.以淀粉溶液为指示剂。逐滴加入物质的量浓度为2.0×10 mol/L的
mol/L的 溶液10.0mL,恰好反应完全。
溶液10.0mL,恰好反应完全。
①判断c中恰好完全反应依据的现象是_____________________________________。
②b中反应所产生的 的物质的量是多少?(写出计算过程)
的物质的量是多少?(写出计算过程)
③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg)。(写出计算过程)
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I- (忽略水的电离),其中Cl-、Br-、I-的个数比为
(忽略水的电离),其中Cl-、Br-、I-的个数比为 2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,求通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比。(已知:还原
2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,求通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比。(已知:还原 性I->Fe2+>Br->Cl-)
性I->Fe2+>Br->Cl-)
(4分)已知固体化合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理回答下列问题:[n(A)表示A的物质的量;m(A)表示A的质量]
(1)取A与足量的盐酸反应:若m(A)为定值,生成气体的量即为定值,试写出A的可能组成。
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通入足量的澄清石灰水,生成的沉淀均为10.0g,据此推导 出A的组成及物质的量。
出A的组成及物质的量。