可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是:①一个N—N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N—N键断裂的同时,有3个H—H键断裂;②一个N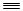 N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
| A.全部 | B.①③④⑤ | C.②③④⑤⑦ | D.①③⑤⑥⑦ |
下列叙述不正确的是
| A.NH3易液化,液氨常用作制冷剂 |
| B.与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 |
| C.铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
| D.稀HNO3和活泼金属反应时主要得到氢气 |
把aL含硫酸铵和硝酸铵的混合液分成2等份,一份需用bmol烧碱刚好把铵全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中NO3-离子的物质量浓度为(单位:mol/L)
| A.(b-2c)/a | B.(2b-2c)/a | C.(2b-4c)/a | D.(2b-c)/a |
某元素的单质与足量浓HNO3反应时,参加反应的单质与HNO3的物质的量之比为1∶4,则反应后的产物中,该元素的价态可能为
| A.+1 | B.+5 | C.+3 | D.+4 |
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是
| A.Fe2(SO4)3 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
X、Y、Z、W均为短周期元素,它们在周期表中的位置如下图所示。若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是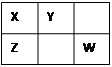
| A.原子半径:Z>X>Y |
| B.最高价氧化物对应水化物的酸性:Z>W |
| C.W的单质是制取盐酸的原料之一 |
| D.X、W的氢化物相遇会产生白烟 |