中科大陈乾旺教授等人发明人工合成金刚石的新方法,其化学原理为: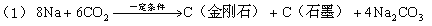
该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是: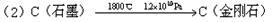
以下有关表述中正确的是
| A.新法(1)利用的是化学变化,旧法(2)利用的是物理变化 |
| B.在反应(1)中,利用了金属钠的还原性 |
| C.在反应(1)中每生成12g金刚石需要消耗23g金属钠 |
| D.在反应(1)和(2)中,金刚石都是还原产物 |
利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
| A.降低温度 |
| B.增大压强同时加催化剂 |
| C.升高温度同时充入N2 |
| D.及时将CO2和N2从反应体系中移走 |
反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l)△H=-Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g)△H=-Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是()
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
将1 mol SO2和1 mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量( )
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量( )
| A.等于0.3 mol | B.等于0.15 mol |
| C.小于0.15 mol | D.大于0.15 mol,小于0.3 mol |
下列表述中正确的是 ( )
| A.任何能使熵值增大的过程都能自发进行 |
B.已知热化学方程式2SO2(g)+O2(g) 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 |
| C.化学平衡发生移动,平衡常数一定发生变化 |
| D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |