下列各项所述的两个量,前者一定大于后者的是
①纯水在25 ℃和80 ℃的pH ② 1 mol NaHSO4和1 mol NaCl在熔化状态下的离子数
③25℃时,等体积且pH都等于3的盐酸和A1C13的溶液中,已电离的水分子数
④Na+和 F¯的离子半径 ⑤含1molFeCl3的饱和溶液与水完全反应转化为氢氧化铁胶体后,
其中胶体粒子的数目与阿伏加德罗常数
| A.①② | B.① | C.①③⑤ | D.②④ |
如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此你得到的信息和作出的推测是( )
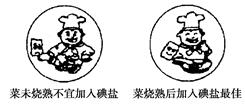 配料表
|
A.人体不能缺碘,需要正常补碘,“加碘食盐”中的“碘”是指碘单质
B.该食盐商品是以海盐为原料,经过加工后的产品,是盐类的纯净物
C.1 kg此食盐中含碘酸钾(35±15) mg
D.“菜未烧熟不宜加入碘盐”的原因可能是碘酸钾受热不稳定
亚硝酸盐中毒,又名乌嘴病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是( )
| A.在中毒过程中血红蛋白被氧化 |
| B.中毒时亚硝酸盐发生氧化反应 |
| C.药品美蓝应具有还原性 |
| D.解毒时血红蛋白被还原 |
生活中碰到的某些问题常常涉及化学知识,下列叙述中正确的是( )
①加碘食盐就是在其中加入碘单质;②用甲醛溶液浸泡海产食品;③用加酶洗衣粉洗涤毛料服装;④河海分界处易沉积成沙洲,是胶体遇电解质溶液聚沉的结果;⑤香肠中可以加大量的亚硝酸钠以保持肉类新鲜;⑥造成大气污染的SO2、CO和NO2,主要来源于煤的燃烧和汽车排放的尾气;⑦用次氯酸钙净化不太澄清的井水;⑧变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
| A.④⑥ | B.③⑥⑧ |
| C.①② | D.全部 |
在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生:①IO3-+5I-+6H+===3I2+3H2O ②I2+HSO3-+H2O===2I-+SO42-+3H+。当反应进行到15 min时,溶液突然变为蓝色,随之又很快消失。这一反应被称做时钟反应,有人用它来解释生物钟现象。下列有关说法不正确的是( )
| A.在整个反应过程中,起催化作用的物质是KI |
| B.上述两个反应中,反应速率较快的是② |
| C.时钟反应的快慢由反应②决定 |
| D.“溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关 |
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2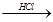 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验序号 |
初始浓度c/mol·L-1 |
溴颜色消失所需时间t/s |
||
| CH3COCH3 |
HCl |
Br2 |
||
| ① |
0.80 |
0.20 |
0.0010 |
290 |
| ② |
1.60 |
0.20 |
0.0010 |
145 |
| ③ |
0.80 |
0.40 |
0.0010 |
145 |
| ④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大