Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,化合物D的焰色反应为黄色,C和G混合冒白烟并生成A,电解E的水溶液常用于某种工业生产。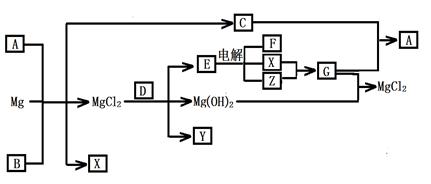
(1)写出下列物质的化学式
A Y
(2)写出C的电子式
(3)写出MgCl2与D反应的化学方程式
(4)请用水解平衡理论解释A+B+Mg→C+X+ MgCl2的原因_______________________。
(5)将0.1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的 关系如下图所示:则原F溶液的浓度为 mol/L。
关系如下图所示:则原F溶液的浓度为 mol/L。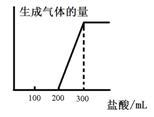
(7分)现有含1mol Fe3+和1molAl3+的混合溶液,按下图横坐标依次加入NaOH溶液、盐酸、通入CO2气体,纵坐标为混合沉淀的物质的量。
(1)请画出沉淀的物质的量随反应的变化曲线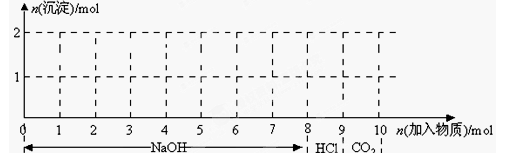
(2)逐步写出:6-7、9-10反应的离子方程式:____________________________________。
(8分)含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为_______________,
②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。写出该反应的离子方程式:_________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如右图所示的A和B曲线,试回答下列问题: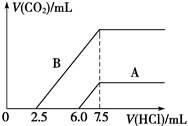
①_______曲线正确,天然碱的化学式为___________,
③加盐酸后产生CO2气体体积(标准状况)的最大值为_________________mL。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。
亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数是________。
(10分)晶体硅是一种重要的非金属材料。请写出晶体硅的二种用途:______、______
制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知:Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___________。
Ⅱ.SiHCl3在空气中自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)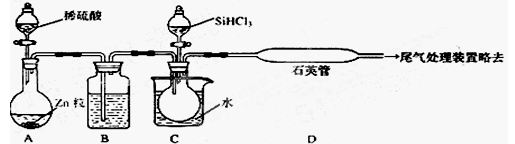
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是______________,
②反应一段时间后,装置D中观察到的现象是 _ ,
装置D中发生反应的化学方程式为 ___ ,
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度
以及 _____________ ,
④设计鉴定产品硅中是否含少量Fe单质的方法:_________________________________。
(10分)在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子。进行下述实验(所加试剂均过量)。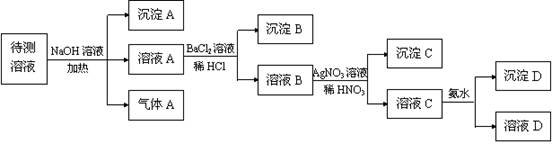
(1)气体A的化学式是,沉淀A的化学式是;
(2)待测液中一定存在;一定不存在 _______;
(3)写出溶液C与过量氨水反应的离子方程式。
(4)三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁(Mg2Si3O8·nH2O)改写成氧化物的形式为,
它中和胃酸(HCl)的离子方程式是:。
自2010年8月7日,甘肃省舟曲县发生特大泥石流后,各地的救援物资远远不断运往灾区。下图为地方捐助的一种国家准字号补铁补血用药——复方硫酸亚铁叶酸片,其主要成分是绿矾——硫酸亚铁晶体(FeSO4·7H2O)。
Ⅰ、某校课外活动小组为测定该补血剂中铁元素的含量特设计实验步骤如下: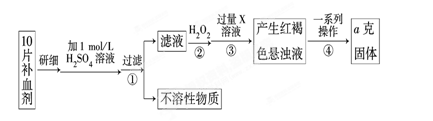
请回答下列问题:
(1)步骤②中加入过量H2O2的目的是。
(2)步骤③中反应的离子方程式为。
(3)步骤④中一系列处理的操作步骤是:过滤、、灼烧、冷却、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为g(用含a的代数式表示)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。某同学设计的下列滴定方式中,最合理的是(夹持部分略去)(填字母序号)。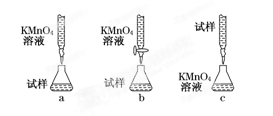
Ⅱ、灾难过后,灾区的饮用水变得非常的浑浊,不能饮用。因此对污染的饮用水的处理成了非常重要的事,其中处理的方法有很多:
(1)可以用适量绿矾和氯气一起作用于污染的自来水,而起到较好的净水效果;理由是(用离子方程式表示)。
(2)在使用过程中发现绿矾和氯气的混合使用对酸性废水中的悬浮物处理效果较差,其原因是。