某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 gNaHCO3固体的烧杯中加入10 mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度T3。
得到下表的数据:
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是 (用离子方程式表示)。
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解_________。
(3)分析表1的数据得出:Na2CO3固体溶于水______,NaHCO3固体溶于水______(填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10 mL_____,搅拌,测量温度为22.2℃。
(5)结合上述探究,下列说法正确的是__________。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为_____(用代数式表示)。
附表:溶解度表
在 Li、
Li、 N、
N、 Na、
Na、 Mg、
Mg、 Li、
Li、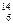 C中:
C中:
(1)和互为同位素。
(2)和 质量数相等,但不能互称同位素。
质量数相等,但不能互称同位素。
(3)和的中子数相等,但质子数不相等,所以不是同一种元素。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验: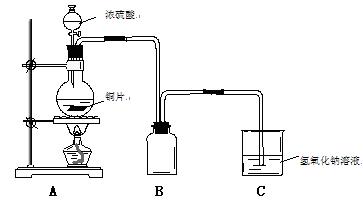
(1). B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2).向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,
①请写出铜跟浓硫酸反应的化学方程式:_____________________________,写出C中发生反应的离子方程式。
②被还原的H2SO4的物质的量
A 小于0.45摩 B 等于0.45摩
C 在0.45摩与0.90摩之间 D 大于0.90摩
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_______ __ (填写字母编号,有几个写几个,多写或写错0分)。
__ (填写字母编号,有几个写几个,多写或写错0分)。
| A.铁粉 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
(3) 常温下,将铁棒置于浓硫酸中.无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面,则发生 了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
(1)某元素的原子结构示意图为: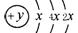 ,该元素符号为_______
,该元素符号为_______ 在周期表位于。
在周期表位于。
(2)写出下列物质的用电子式:
MgCl2:_____________。CO2:_______________。KOH________________。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
| 主族 周期 |
IA |
ⅡA |
IIIA |
ⅣA |
ⅤA[ |
ⅥA |
ⅦA |
0族 |
| 1 |
① |
|||||||
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|||
| 4 |
⑩ |
(1)在这些元素中,化学性质最不活泼的元素名称是,最高价氧化物对应的水化物是两性氢氧化物的元素是,⑤⑥⑩元素中原子半径最大的元素为。⑧号元素的原子结构示意图为。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,⑧、⑨号元素的氢化物中还原性较强的是。
(3)②与③形成的化合物属于(填“共价”或“离子”)化合物,。
(4)⑥号元素与水反应的化学方程式为。
制造光导纤维的原料名称是,水泥、玻璃、陶瓷属于工业,日本福岛 核电站释放的137Cs和134Cs彼此互称为,白磷和红磷互称为。
核电站释放的137Cs和134Cs彼此互称为,白磷和红磷互称为。