目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程 式_____________________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下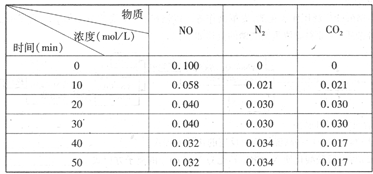
①不能作为判断反应达到化学平衡状态的依据 是_______
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在T。C时.该反应的平衡常数为_______(保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
2CO+2NO N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
①上表中:a=_______,b=________,e=________
②请在给出的坐标图中,画出上表中实验II和实验III条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明相应的实验编号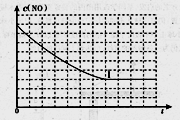
某原子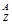 X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
(1)Z值=和A=值;
(2)X元素在周期表中的位置第周期族。
化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
(1)我们可以通过计算确定A的化学式,其中x=,y=;
(2)已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是,结构式是。
(1)在1—18号元素中,能形成最稳定气态氢化物的元素是 ;与水或酸反应最剧烈的金属单质是;最高价氧化物的水化物中碱性最强的元素是;最高价氧化物的水化物中酸性最强的元素是。(填写元素符号)
(2)物质在下列变化过程中克服的是:a分子间作用力 b共价键 c离子键(填序号)
①冰融化;
②食盐熔化;
③H2S受热分解成S和H2;
④NaHSO4溶解于水;
(3)共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是_________
| A.干冰 | B.氯化钠 | C.氢氧化钠 | D.碘 |
(4)氮化钠是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答,Na3N的电子式是________, Na3N与盐酸反应方程式_____________________________________;
已知:C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ/mol;2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ/mol,现有0.2 mol的炭粉和氢气组成的悬浮气且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为。家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧热的热化学方程式:
25℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(选填“>”、“<”、或“=”)
(3)求出混合液的下列算式的精确计算结果(填具体数字):
c(Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液是中性,又知将HA溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7 (选填“>”、“<”或“=”);
(5)将相同温度下浓度相同的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列(填序号)