A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能 级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最 小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余 能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素A、B、C的第一电离能由小到大的是_______用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为_______。
(3)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。
(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是_______
(5)已知DE晶体的晶胞如下图所示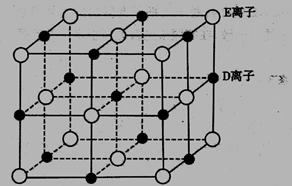
若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小 立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原 子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A — A键的键长 为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_____个A原子,该晶体的密度是_____ g/cm
已知几种离子的还原能力强弱顺序为I—>Fe2+>Br—,现有200mL混合溶液中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其它反应)。
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是,剩余Fe2+的物质的量为。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为,若最终所得溶液为400mL,其中主要阳离子及其物质的量浓度为。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式,上述所有反应共消耗Cl2mol。
在某无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、Cl-、OH-、HCO3—、NO3—。已知该溶液能跟铝粉反应,且放出的气体只有H2。试回答:
(1)若溶液和铝粉反应后有AlO2-生成,则溶液中一定含有大量的_____________离子,还可能含有大量的________离子。
(2)若溶液和铝粉反应后有Al3+生成则溶液中一定含有大量的________离子,原溶液中一定不含有大量的________离子。
无机化合物可根据其组成和性质进行分类,以下是一组对“一些物质与水反应”的分类图,请按要求填空.
(1)上述分类中,分成A、B两组的依据是.
(2)C组物质与水反应的离子方程式为.
(3)D组物质与水反应中,氧化剂和还原剂物质的量之比为1:1的物质有(填化学式).
下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题: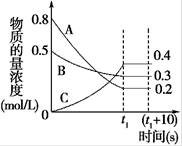
(1)该反应的化学方程式为。
(2)0~t1s 内B气体的平均反应速率为。
(3)(t1+10)s 时,A的转化率为,此时v(A)正v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为。
C、N、O、Al、Si、Cl、Fe是七种常见元素
(1)N元素位于周期表第周期,第族,C元素的一种同位素可测定文物年代,这种同位素的符号是。
(2)用“>”、“<”或“= ”填空:
| 离子半径 |
得电子能力 |
酸性 |
金属性 |
| O2―Al3+ |
16O18O |
H2CO3HNO3 |
FeAl |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为,电池负极反应的电极方程式为。