C、N、O、Al、Si、Cl、Fe是七种常见元素
(1)N元素位于周期表第 周期,第 族,C元素的一种同位素可测定文物年代,这种同位素的符号是 。
(2)用“>”、“<”或“= ”填空:
| 离子半径 |
得电子能力 |
酸性 |
金属性 |
| O2― Al3+ |
16O 18O |
H2CO3 HNO3 |
Fe Al |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为 。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目 。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为 ,电池负极反应的电极方程式为 。
(每空2分,共14分)电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①Y电极上的电极反应式为____________________,该电极产生的现象是。
②该反应的总反应化学方程式是: ______________________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是__________,电极反应式是____________________。
(3)若用惰性电极电解500 mL CuSO4溶液,溶液中 Cu2+ 完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极质量增加1.6 g。
①要使电解后溶液恢复到电解前的状态,需加入一定量的________(填加入物质的化学式)。(假设电解前后溶液的体积不变)
②溶液的pH=。
某小组对过氧化钠的性质和用途进行探究。
(1)观察其外观,可获知的物理性质是。
(2)将CuSO4溶液加入盛有少量Na2O2固体的试管中,可以观察到的现象是,发生反应的化学方程式依次为。
(3)Na2O2可用于潜水艇中作为氧气的来源,若消耗100g Na2O2,能生成标准状况下多少体积的O2?(写出计算过程)
某工厂的工业废水中含有大量的FeSO4,较多的Cu2+和少量Na+。该工厂计划从废水中回收FeSO4和金属铜。根据下列流程图,回答问题。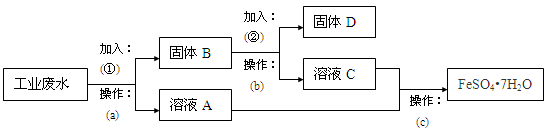
(1)a操作需要用到的玻璃仪器有。
(2)加入的试剂①为,要判断所加试剂①是否过量,其操作方法是。
(3)加入试剂②发生反应的离子方程式是。
(4)c操作为、冷却结晶、、洗涤、干燥。
粗盐中除含有Ca2+、Mg2+、SO42-等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO42-的方法是。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。这些操作的目的是, 滴加Na2CO3溶液时发生反应的化学方程式为。
(3)用提纯后的NaCl固体配制100mL 1.0 mol/L NaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙外,还需要 (填仪器名称)。转移溶液时没有洗涤烧杯会造成所配溶液浓度偏________(填“高”或“低”,下同);定容时仰视刻度线会造成所配溶液浓度偏________。
北京市规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
Ⅰ.用天平准确称取5.0 g食盐样品,加适量蒸馏水使其完全溶解。
Ⅱ.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
Ⅲ.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液3.0 mL,恰好反应完全。
(1)步骤Ⅱ中反应后碘元素以形式(填物质的化学式)存在。
(2)已知步骤Ⅲ中S2O32-反应后转化为S4O62-,写出步骤Ⅲ的离子方程式。
(3)上述实验样品中碘含量是mg/kg。