用铜、银与硝酸银设计一个原电池,此电池的负极是: ,负极的电极反应式是: 总反应方程式为  。
。
化肥在农业生产中占有重要位置,目前使用的合成氨催化剂是由四氧化三铁主催化剂和助催化剂(万分之一氧化铝和万分之一氧化钾等)组成。N2和H2在催化剂表面反应机理如下(Cata是catalyst缩写,表示催化剂):
①N2(g)+Cata→2N(Cata)
②H2(g)+Cata→2H(Cata)
③N(Cata)+H(Cata)→NH(Cata)
④NH(Cata)+H(Cata)→NH2(Cata)
⑤NH2(Cata)+H(Cata)→NH3(Cata)
⑥…
试探究下列问题:
(1)请补充⑥(最后一步反应)机理的式子:▲;
(2)从共价键键能分析,可能最慢的一步是:▲(填数字),该过程: ▲(填放热或吸热)。
(3)石灰氮是一种氮素肥效长的肥料,同时也是一种低毒﹑无残留的农药,它可由电石与氮气反应得到,石灰氮中阳离子与阴离子具有相同的质子总数,试写出制备石灰氮的化学方程式:▲。
(4)某研究性学习小组拟用甲醛法测定常见铵态氮肥的含氮量,(资料支撑: 4NH4+ + 6HCHO = (CH2)6N4H+ + 3H+ + 6H2O,所生成的H+和(CH2)6N4H+可用NaOH标准溶液滴定,采用酚酞作指示剂)。用甲醛法测定含氮量,不适合的铵盐是:▲(选填序号)。
| A.NH4Cl | B.(NH4)2SO4 | C.NH4NO3 | D.NH4HCO3 |
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
能形成双原子分子,原子间存在3对共用电子对 |
| X |
M层有3个电子 |
| Y |
最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维 |
| Z |
最高正价为+7价 |
(1)写出元素Z的离子结构示意图▲。
Y的最高价氧化物中,化学键Y—O的物质的量与Y的物质的量之比为: ▲(填数字)。
(2)X的最高价氧化物与烧碱反应的离子反应方程式为:▲。
(3)Z的非金属性比T元素强,用化学方程式表示:▲。
(4)XT是一种新型的无机材料,可由X的最高价氧化物与T的单质及焦炭反应生成,逸出的气体具有可燃性,写出反应方程式,并标出电子转移方向和数目。
▲。
选择性催化还原(SCR)是在有催化剂的条件下将NOx 转变为N2和H2O,这是目前国外硝酸厂进行尾气治理所普遍采用的一种方法。
某校甲、乙两个化学兴趣小组拟验证NO能被氨气还原并测算其转化率。
(一)甲组拟制取活性亚铬酸铜催化剂
亚铬酸铜(Adkin催化剂)是极好的NO催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:CuO·Cr2O3等,统称为亚铬酸铜。该组同学取一定量硝酸铜溶液(并加少量硝酸钡作稳定剂)、 重铬酸铵溶液与氨水作用得土黄色沉淀, 将沉淀物[经测定为:碱式铬酸铜铵(CuNH4(OH)CrO4 )]过滤、洗涤,80℃烘干12h, 最后焙烧。
(1)过滤用到的玻璃仪器有:▲(选填序号,下同);焙烧用到的仪器有: ▲。
| A.蒸发皿 | B.石棉网 | C.泥三角 | D.烧杯 E.坩埚钳 F.酒精灯 |
G.玻璃棒 H.漏斗 I.坩埚(部分仪器已略去)
(2)CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,该反应的化学方程式:▲。
(二)乙组拟用甲组制得催化剂按下列流程进行实验。
试回答下列问题:
(3)若制取氨气在A装置,则发生反应的化学方程式为:▲;
若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是:▲。
(4)用图C装置制取NO时,用可抽动的铜丝其优点是:▲;
(5)装置⑦的作用可能是:▲。
(6)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mLN2,则NO的转化率为:▲。
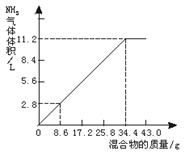
(1)NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140 mL,固体混合物的质量是51.6 g时,充分反应后,生成气体的体积(标准状况)为________ L。
(3)当NaOH溶液的体积为180 mL,固体混合物的质量仍为51.6 g时,充分反应后,生成气体的体积(标准状况)为________ L。
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
(2)
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO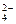 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因:。