下表是元素周期表的一部分,回答下列有关问题
(1)写出下列元素符号:① ________,⑥ ________。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。(用化学式表示)
(3)已知⑦的一种单质具有强氧化性,能使淀粉碘化钾式纸变蓝,化学方程式为,
O3+2KI+H2O=2KOH+I2+O2当生成1.27克碘时,转移的电子数为 .
重晶石(BaSO4)是重要的化工原料,制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下:
(1)写出煅烧时发生反应的热化学方程式:____________________________。
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式:_____________________。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:_____。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为:
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
现有0.20 mol BaSO4,加入1.0L 2.0mol•L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0
平衡时,K=4.0x10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(写出计算过程结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:________________________。
在一定条件下,NO与NO2混合可生成N2O3,反应的化学方程式为:NO(g)+NO2(g) N2O3(g) ΔH<0
N2O3(g) ΔH<0
下图表示一定量的NO、NO2混合气体发生反应时,NO2浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。
(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向_______移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:___________________________________,该反应的氧化剂是______________。
化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有A12O3、 SiO2等杂质)为主要原料生产,其主要工艺流程如下:
步骤①中主要反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是。
(2)杂质A12O3、SiO2在①中转化的化学反应方程式为。
(3)用化学平衡移动原理说明③中煮沸的作用是(用离子方程式结合文字说明),若调节pH过低产生的影响是。
(4)⑤中酸化是使CrO42一转化为Cr2O72一,写出该反应的离子方程式:。
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如下: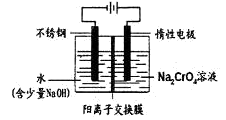
阴极发生的电极反应式为:。
阳极发生的电极反应式为:。
运用反应原理研究氮、硫、氯、碘及其化合物的反应有重要意义。
(1)在反应:2SO2(g)+O2(g) 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):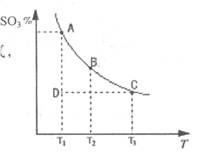
①2SO2(g)+O2(g) 2SO3(g)的△H0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将移动(填“向左”、“向右”或“不”);
2SO3(g)的△H0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将移动(填“向左”、“向右”或“不”);
②当温度为T1,反应进行到状态D时,V正V逆(填“>”、“<”或“=”)。
(2)①下图是一定条件下,N2和H2发生可逆反应生成1mol NH3的能量变化图,该反应的热化学反应方程式。(△H用含Q1、Q2的代数式表示)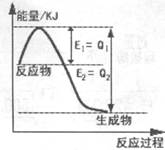
②25°C时,将a mol • L―1的氨水与b mol • L―1的盐酸等体积混合,所得溶液的pH=7,则c (NH4+)c(Cl―),ab(填“>”、“<”或“=”);
(3)海水中含有大量以化合态形式存在的氯、碘元素。已知:250C时,Ksp(AgCl)=1.6×10―10mol2•L―2、Ksp(AgI)=1.5×10―16mol2•L―2。
在 250C时,向 10mL0.002mol•L―1的 NaCl溶液中滴入 10mL0.002mol•L―1AgNO3溶液,有白色沉淀生成,向所得浊液中继续滴人0.1mol •L―1的NaI溶液,白色沉淀逐渐转化为黄色沉淀,其原因是,该反应的离子方程式。
某氧化铁样品中含有少量的FeSO4杂质。某同学要测定其中铁元素的质量分数,他设计了如下方案进行测定,操作流程为: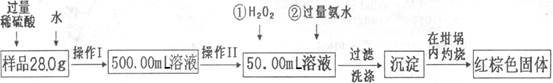
请根据流程回答:
(1)操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有(填仪器名称)。
(2)操作II中必须用到的仪器是。
| A.50mL量筒 | B.100mL量筒 |
| C.50mL酸式滴定管 | D.50mL碱式滴定管 |
(3)反应①中,加入足量H2O2溶液反应的离子方程式。
(4)检验沉淀中SO42-是否冼涤干净的操作
。
(5)将沉淀物加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为blg,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,还应进行的操作是
。
(6)若坩埚的质量为42.6g,最终坩埚与加热后同体的总质量为44.8g,则样品中铁元素的质量分数=(保留一位小数)。
(7)另一同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水后充分搅拌,加热蒸干灼烧称量即可,请你评价他的这个方案是否可行?。(填“可行”或“不可行”)