柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程: 请
请
根据以上流程,回答相关问题:
(1)操作④需要的玻璃仪器有:玻璃棒、烧杯、__________。
(2)操作③的名称: 。
(3)对上述操作②后的无色溶液进行除杂提纯,甲同学提出新的方案。其方案如下:
[设计除杂过程]
(i)若在操作⑤结束后发现溶液E略有浑浊,应采取的措施是 ;
(ii)试剂X是 (填化学式)。
[获取纯净氯化钾]
(ⅲ)对溶液E加热并不断滴加l mol· L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液F。
(ⅳ)将溶液F倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 ,停止加热。
[问题讨论]
(ⅴ)进行操作⑤前,需先加热,使沉淀颗粒增大,便于过滤;该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时悬浊液D中Mg2+物质的量浓度 mol/L。
(已知Ksp(MgCO3)= 3.5×10一5 Ksp[Mg(OH)2]= 1.6×10一11)
工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为:
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
3.方案三的实验装置如下图: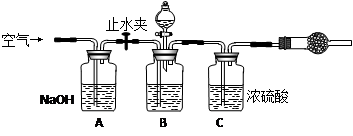
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)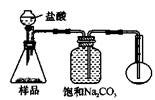

A B

C D
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
⑴ 若A是一种黄色单质固体,则B→C的化学方程式为。
⑵ 若A是一种活泼金属,C是淡黄色固体,则C的名称为,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理。
⑶若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,且B和C易在空气形成光化学烟雾。
①则A为,C为,(填写化学式)
实验室用熟石灰与氯化铵固体共热制取A,写出此化学方程式:。
②写出C与水反应的化学方程式:。
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
I、把氯气通入含淀粉碘化钾的溶液中,可观察到的现象是: ,
说明氯单质的氧化性 碘单质的氧化性。(填﹤,﹥,=)
Ⅱ、某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用离子方程式表示) 。
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液需要 L才能与标准状况下2.24 L氯气恰好完全反应。
(3)配制250 mL 4.0mol·L-1NaOH溶液的实验步骤:
a、计算需要氢氧化钠固体的质量。
b、称量氢氧化钠固体。
c、将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入250 mL容量瓶。
d、用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e、盖好瓶塞,反复上下颠倒,摇匀。
f、继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管加蒸馏水至凹液面最低液而与刻度线相切。
①所需称量的氢氧化钠固体的质量是 。
②上述步骤的正确操作顺序是 。
③上述实验需要的仪器有:天平、药匙、烧杯、玻璃棒、 、 。
(9分)为了探究HClO的漂白性,某同学设计了如下的实验。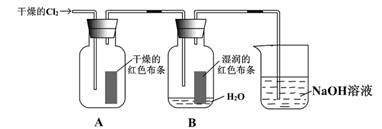
(1) 写出C12与水反应的化学方程式________________________
(2) 通入C12后,集气瓶A中的现象是__________________,集气瓶B中的现象是_______________,可得出的结论是___________________________。烧杯中的NAOH溶液的作用是,其反生反应的离子方程式为
取一小块金属钠,用滤纸吸干表面的煤油,用小刀切开后,可看到断面呈___________色,具有________光泽,但断面很快变_________,主要是由于生成一薄层________________。若把钠水中,其反应的化学方程式为_____________________________。