(9分)为了探究HClO的漂白性,某同学设计了如下的实验。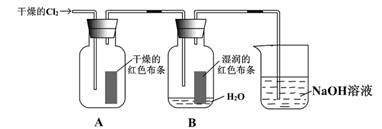
(1) 写出C12与水反应的化学方程式________________________
(2) 通入C12后,集气瓶A中的现象是__________________,集气瓶B中的现象是_______________,可得出的结论是___________________________。烧杯中的NAOH溶液的作用是 ,其反生反应的离子方程式为
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,PCl3遇水会强烈水解生成 H3PO3和HCl。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为。
(2)B中所装试剂是,E中冷水的作用是F中碱石灰的作用是_____。
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
生活中为了延长鲜花的寿命,通常会在花瓶中加入“鲜花保鲜剂”。下表是0.5L某种“鲜花保鲜剂”中含有的成分及含量,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g/mol) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.25 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.25 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是。
A.蔗糖B.硫酸钾C.高锰酸钾D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为mol·L-1。
(要求用原始数据书写出表达式,不需要化简)
(3)为了研究不同浓度的“鲜花保鲜剂”的保鲜功效,需配制多份不同物质的量浓度的溶液进行研究。现欲配制480mL某物质的量浓度的“鲜花保鲜剂”,所需的玻璃仪器有:烧杯、玻璃棒、、。(在横线上填写所缺仪器的名称)
(4)配制上述 “鲜花保鲜剂”时,其正确的操作顺序是(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G.用电子天平称量各组成成分,并把它们放入烧杯中混合
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线。
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中。
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式:。
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用。
试管a中的现象是 ,作用是 。
试管b中的现象是 ,作用是 。
氨气具有广泛的用途。
(1)工业上合成氨反应的化学方程式是。

(2)实验室常用如上图所示装置制取并收集氨气。
① 实验室制取氨气反应的化学方程式是。
② 图中方框内收集氨气的装置可选用(填字母序号)。
③ 尾气处理装置中使用倒扣漏斗的作用是。
(3)工业上用NH3制取NO反应的化学方程式是。
实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
| A.容量瓶洗涤后残留少量水不影响使用 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制NaOH溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制硫酸溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次摇匀。
(3)用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(保留到小数点后1位。),若实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。