半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,PCl3遇水会强烈水解生成 H3PO3和HCl。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 F中碱石灰的作用是_____。
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
资料显示:“氨气可在纯氧中安静燃烧……某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。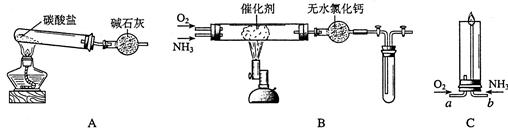
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是;碱石灰的作用是。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是
试管内气体变为红棕色,该反应的化学方程式是
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中。试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通人到装置C中,并在b管上端点燃氨气,两气体通入的先后顺序是,其理由是
实验室配制500mL 0.1mol/L Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取石碱晶体(十水碳酸钠)________g;
(2)配制Na2CO3溶液时需要使用的主要仪器有托盘天平、烧杯、钥匙、________、________、________、
(3)若实验遇到下列情况,溶液的浓度是偏高,偏低还是不变?
①加水时超过刻度线,再用滴管吸出直至刻度线________;
②忘记将洗涤液加入容量瓶________;
③容量瓶内壁附有水珠而未干燥处理________;
④定容后摇匀,液面低于刻度线________。
(9分) 硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2 等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下: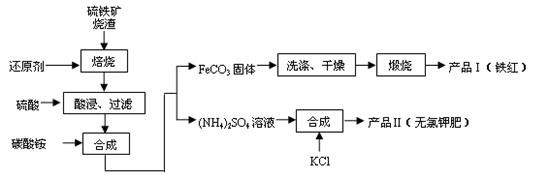
已知几种盐的溶解度随温度变化的曲线如下图所示: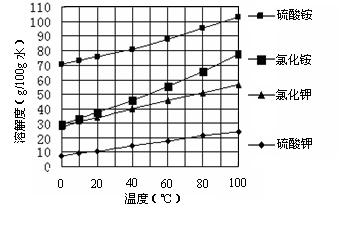
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品I的化学反应方程式为________________________________。实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为_______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,滴加过量Ba(NO3)2溶液,过滤后向滤液滴加硝酸酸化的AgNO3溶 液。判断Ba(NO3)2已过量的方法是。
液。判断Ba(NO3)2已过量的方法是。
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为: 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I称取样品1.400 g。
步骤II将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
| 滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为___________。
如图所示,实验室用NH4Cl和Ca(OH)2制取NH3。试回答下列问题:
(1)写出反应的化学方程式
(2)B处的药品是
(3)检验D处试管中NH3是否收集满,除用湿红色石蕊试纸外,还可用方法是
。
(4)在标准状况下,收集到224mlNH3后,将它溶于水中,恰好得到100ml氨水,则最后所得溶液的物质的量浓度为mol/L