为了粗略测定电石中碳化钙的质量分数,某研究性学习小组设计了如下图所示的制气与除杂装置。请参与研究并回答相关问题: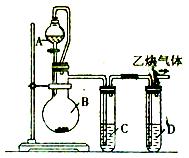
(1)写出烧瓶B中发生反应的 化学方程式:__________________________。
化学方程式:__________________________。
(2)漏斗与烧瓶之间用玻璃导管连接,其目的是_____________________________________。
(3)试管中装有同一种蓝色溶液,该溶液是____________,其中试管C的作用是_______________________,试管D的作用是____________ ____________。
____________。
(4) 为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______
为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______ __(填Ⅰ或Ⅱ)。
__(填Ⅰ或Ⅱ)。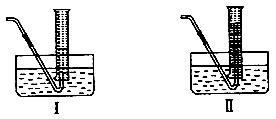
㈠用pH试纸测定溶液pH的正确操作是______________________________________
㈡某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
⑴盛装0.2000 mol/L盐酸标准液应该用式滴定管。
⑵滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_____________。
⑶ 滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为:。
⑷有关数据记录如下:则NaOH溶液的物质的量浓度为______________mol/L。
| 实验序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.55 |
| 2 |
20.00 |
8.00 |
26.00 |
| 3 |
20.00 |
1.40 |
21.35 |
⑸滴定前平视读数,滴定终点时俯视读数,则会使所测碱的浓度值。
(填“无影响”、“偏高”或“偏低”)。
资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。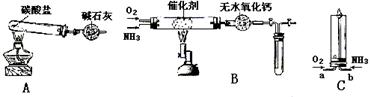
(1)氨分子的空间结构是。若将氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热进行氨的催化氧化,试管内出现的现象是。
(2)停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气,两气体通入的先后顺序应该是。
(4)已知氨气在纯氧中燃烧,氮元素全部转化成N2,请写出该反应的化学方程式。
实验室中可用如图装置来制取干燥的氨气。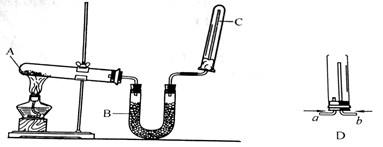
(1)写出A处发生反应的化学方程式;
(2)U形管B中所放的药品是;
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是。
A、氢气 B、氧气 C、氯气 D、二氧化碳
(4)试管C的管口处要放置一小团棉花,放置棉花的作用是;
(5)资料显示:“氨气可在纯氧中点燃,反应生成氮气和水”。为验证此事实,某同学设计了一个实验方案,装置见D。请写出该反应的化学方程式。
在面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。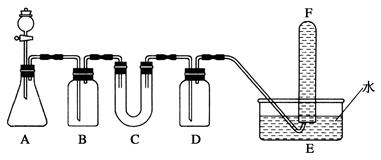
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:。
(2)填写表中空格:
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:。
(4)试管F中收集满气体后,下一步实验操作是。
(11分)为证明有关物质的性质,某学生设计了如图所示的装置。当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮。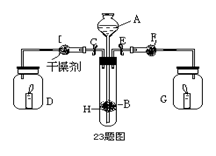
(1)请判断各仪器中盛放的物质的化学式:
A; B;F。
(2)用化学反应方程式表示上述有关反应(不包括蜡烛的燃烧):
,
,
.