已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):
H2(g)+Cl2(g)=2HCl(g),△H=-Q1kJ•mol-1;H2(g)+Br2(g)=2HBr(g),△H=-Q2kJ•mol-1。
有关上述反应的叙述正确的是
| A.Q1>Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.生成lmolHCl气体时放出Q1热量 |
| D.1mol HBr(l)具有的能量大于lmol HBr(g)具有的能量 |
某物质可能含有甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种,在鉴定时有下列现象:(1)有银镜反应;(2)加入新制氢氧化铜悬浊液少许,沉淀不溶解;(3)与含酚酞的氢氧化钠溶液共热,红色逐渐消失。下列叙述正确的是
| A.四种物质都存在 | B.有甲酸乙酯和甲酸 |
| C.有甲酸乙酯和甲醇 | D.有甲酸乙酯,可能有甲醇 |
2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9 g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能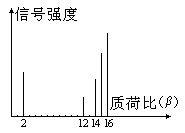
| A.CH3OH | B.C3H8 | C.C2H4 | D.CH4 |
下列有机物可以形成顺反异构的是
| A.2,3-二甲基-2-丁烯 | B.1-氯-1-丙烯 |
| C.2-甲基-2-丁烯 | D.丙烯 |
某同学在所收到的信封上发现有收藏价值的邮票,便将邮票剪下来浸入水中,以去掉邮票背面的黏合剂。根据“相似相溶”原理,该黏合剂的成分可能是
盐酸洛派丁胺俗称易蒙停,它是一种新型的止泻药,适用于各种急慢性腹泻的治疗,其结构简式如图:下列说法正确的是
| A.易蒙停的分子式为C29H33Cl2N2O3 |
| B.向易蒙停溶液中加入FeCl3溶液,溶液显紫色 |
| C.1mol易蒙停只能与lmolNaOH发生反应 |
| D.lmol易蒙停最多能与3mol溴水发生反应 |