甲、乙两上实验小组分别进行测定Na2CO3和NaC1混合物中Na2CO3含量的实验。
甲组:沉淀分析法(相对分子质量:Na2CO3为106; BaCO3为197; BaCl2为208) (1)配制一定物质的量浓度的BaC12溶液:用已经称量好的 gBaC12固体配制0.4mol·L—lBaCl2溶液250 mL,所需要的仪器为量筒和 。
(1)配制一定物质的量浓度的BaC12溶液:用已经称量好的 gBaC12固体配制0.4mol·L—lBaCl2溶液250 mL,所需要的仪器为量筒和 。
(2)把m g混合物溶解后加入过量BaC12溶液,然后将所得沉淀过滤、洗涤、烘干、称量,固体质量为wg,根据沉淀质量计算原混合物中Na2CO3的质分数为 (用含m、w的代数式表示)。如果原溶液中过量的Ba2+浓度达到0.01mol/L,则溶液中残留的CO32—的物质的量浓度是 。
乙组:气体分析法
(3) 实验中待锥形瓶中不再产生气体后,打开活塞从导管A端缓缓鼓入一定量的空气,这样做的目的是 。
实验中待锥形瓶中不再产生气体后,打开活塞从导管A端缓缓鼓入一定量的空气,这样做的目的是 。
(4)装置中干燥管B的作用是 。
(5)除已理的agNa2CO3样品外,实验中还应测定的数据是 处(填图中仪器的名称)装置实验前后的质量差。
(6)该实验还存在的明显缺 陷是 。
陷是 。
Ⅰ.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
| A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞 |
| B.用标准溶液润洗滴定管2-3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm |
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)实验中眼睛注视_______,直至滴定终点。判断到达终点的现象是___________。
(3)滴定前平视KOH液面,刻度为amL,滴定后俯视液面刻度为bmL,则(b-a)mL比实际消耗KOH溶液体积(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际填“大”或“小”)。
(4)若酸式滴定管没有用盐酸润洗,对测定结果有何影响____________(填“偏大”、“偏小”或“无影响”,其他操作均正确)。
Ⅰ、为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题: 
(1)请写出CO2与过量的NaOH发生反应的离子方程式:。
(2)选择任意一种实验装置进行实验,简述预计出现的实验现象。你选择的实验装置是(填“甲”或“乙”或“丙”),实验现象是。
(3)上述实验中,如果二氧化碳过量,还可能生成(写化学式),写出生成此物质的离子反应方程式
Ⅱ、为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通。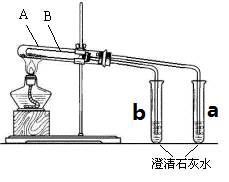
(1)小试管B中应装的药品是(写化学式)。
(2)小试管a中出现的现象预计是。
Ⅲ、工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀经______________(填操作)、洗涤、烘干、称量,洗涤沉淀的操作是。
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液为饱和碳酸氢钠溶液,因为二氧化碳难溶于饱和碳酸氢钠溶液,但选用该溶液后实验结果仍然不够准确,会使Na2CO3的质量分数偏大,其原因可能是。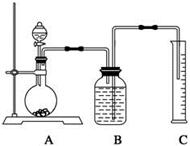
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_____________________________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。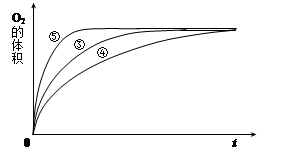

分析上图能够得出的实验结论是______________________________________。
(一)下图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去)。请根据要求完成下列各题。
(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应。所选装置的顺序依次为(从左向右)
(2)A中发生反应的化学方程式为;
(3)实验过程中,先点燃(写字母编号)处的酒精灯,观察到什么现象_______再点燃(写字母编号)处的酒精灯。E管中的反应现象
(二)化学反应的产物往往跟反应条件密切相关,下图中:
①为氯气发生装置;
②的试管里盛有15 mL 4mol/L NaOH溶液,并置于水浴中;
③的试管里盛有15 mL 0.5mol/LNaOH溶液,并置于冰水浴中;
④为尾气吸收装置。
实验结果表明②中有氯酸钠生成③中有次氯酸钠生成。
(4)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①;
②。
(5)反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是(填写编号字母);从②的试管中分离出该晶体的方法是(填写实验操作名称)。
(三)(6)若实验中大约需要225mL0.5mol/L的NaOH溶液,至少需要称量NaOH固体___________g,现有可供选择的仪器:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥500mL容量瓶 ⑦托盘天平 。配制上述溶液还需提供的仪器有____________________
Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。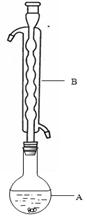
④滤液在经过、后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________。其作用是____________________。
加入的硫粉用乙醇润湿的目的是。
(2)步骤④应采取的操作是、。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是。
如果滤液中该杂质的含量不很低,其检测的方法是:。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+ I2= S4O62-+ 2I-),滴定结果如下:
| 滴定次数 |
滴定前读数(mL) |
滴定滴定后读数(mL) |
| 第一次 |
0.30 |
31.12 |
| 第二次 |
0.36 |
31.56 |
| 第三次 |
1.10 |
31.88 |
则所得产品的纯度为,你认为影响纯度的主要原因是(不考虑操作引起误差)。