现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因。
(1)用CO2和氢气合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH、H2的燃烧热分别为—726.5kJ/mol、—285.8kJ/mol,写出工业上用CO2和H2合成CH3OH的热化学方程式: 。
(2)用铂作电极,一极通入空气,一极通入CH3OH(l),与KOH溶液可组成燃料电池,其负极反应式为 ___。溶液中的阴离子向 极定向移动。
(3)如图是一个电化学装置示意图,用CH3OH—空气燃料电池作此装置的电源。
①如果A为粗铜,B为纯铜,C为CuSO4溶液。该原理的工业生产意义是 。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液。通电后,
若B极增重10.8 g,该燃料电池理论上消耗____mol甲醇。(计算结果保留两位有效数字)
(4)常温下向1L、0.2 mol/L NaOH溶液中通入4.48 L(标准状况)的
SO2(忽略混合后溶液体积的变化),若测得溶液的pH<7,则溶液中c(SO32—)_ c(H2SO3)(填“>”、“<”、或“=”)。有关该溶液中离子浓度关系的判断正确的是 (填字母编号)。
A.c(S O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+) O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+) |
| B.c(H2SO3)+c(HSO3—)+c(SO32—)=" 0.2" mol/L |
| C.c(H2SO3)+c(H+)=c(SO32—)十c(OH-) |
| D.c(Na+)>c(H+)>c(HSO3—)>c(OH—) |
(每空1分,共10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)B的氢化物的分子空间构型是。其中心原子采取杂化。
(3)写出化合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为;另一种只由B组成的离子与AC2互为等电子体,其化学式为。
(4)E的核外电子排布式是,ECl3形成的配合物的化学式为。
(5)D单质晶体堆积为____________________。用●表示D原子,在方框内画出其晶胞图。
(每空1分,共20分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、_____晶体。
(7)画出D的核外电子排布图_____________________,这样排布遵循了_______规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________
每空2分,共10分)
根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
(1)在周期表中,最可能处于同一族的是()
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)电解它们的熔融氯化物或氧化物,阴极电极反应式最可能正确的是()
A.Q2++2e-→Q B.R2++2e-→R C.S3++3e-→S
D.T3++3e-→TE.U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是()
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(4)S元素最可能是()
A.S区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是()
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1)D.氢(1s1)E氦(1s2)
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系, 已知C为密度最小的气体。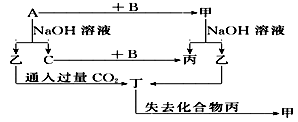
根据图示转化关系回答:
(1)若甲是电解质?写出下列物质的化学式:甲________,乙________,丁________?
写出乙与过量CO2反应的离子方程式_______________________?
(2)若甲是非电解质?写出下列物质的化学式:甲________,乙________,丁________?
(8分)类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。请结合元素周期律完成下列问题:
| 元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃) |
-218.4 |
113 |
450 |
|
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
(1)硒的熔点范围可能是。
(2)碲的化合价可能有。
(3)氢硒酸有较强的还原性。因此放在空气中长期保存易变质,其可能发生的化学方程式为:
。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
Al2Te3+→Al(OH)3↓+ H2Te↑