茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素。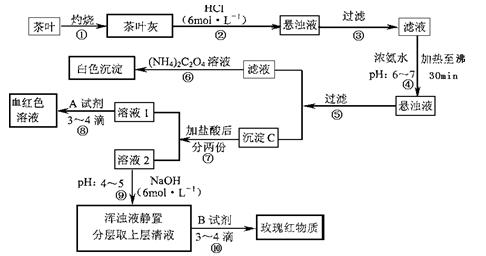
【资料查询】: 草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、
草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、
A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 。
(2)步骤③操作中用到的玻璃仪器有 。
(3)写出步骤⑥中检验Ca2+存在的离子方程式 。
(4)写出沉淀C所含主要物质的化学式 。
(5)写出步骤⑧中选用A试剂的化学式  。
。
(6)步骤⑨的作用是 ,
猜测步骤⑩的目的是 。
常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
(1)TiCl4遇水强烈水解,写出其水解的化学方程式。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是。
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为。
③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K=。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是(填序号)。
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。
催化剂中n(Mn)/n(Cu)约为时最有利于二甲醚的合成。
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵: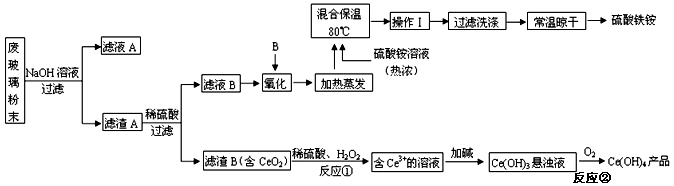
已知:
①酸性条件下,铈在水溶液中有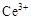 、
、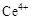 两种主要存在形式,
两种主要存在形式,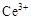 易水解,
易水解,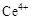 有较强氧化性。
有较强氧化性。
②CeO2不溶于稀硫酸
③硫酸铁铵[aFe2(SO4) 3•b(NH4) 2SO4•cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是(填序号)。
a.NaClOb.H2O2c.KMnO4
(2)操作Ⅰ的名称是,检验硫酸铁铵溶液中含有NH4+的方法是。
(3)写出反应②的化学方程式。
(4)用滴定法测定制得的Ce(OH)4产品纯度。
所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为(写出必要的计算步骤,否则不得分)。
【化学-选修5有机化学基础】
咖啡酸苯乙酯 是一种天然抗癌药物。在一定条件下能发生如下转化。
是一种天然抗癌药物。在一定条件下能发生如下转化。
请回答下列问题:
(1)A分子中的官能团是_______________________________。
(2)高分子化合物M的结构简式是_______________________________。
(3)写出A→B反应的化学方程式:__________________________________。
(4)A→B的反应类型为__________;E→M的反应类型为________;B→C的反应类型为__________。
(5)A的同分异构体有很多种,其中同时符合下列条件的同分异构体有________种。
①苯环上只有两个取代基 ②能发生银镜反应
③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应
【化学-选修3物质结构与性质】(15分)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_______个未成对电子,Fe3+的电子排布式为_________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为____________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的 键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有个铜原子。
键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数 nm,晶胞中铝原子的配位数为。列式表示Al单质的密度g
nm,晶胞中铝原子的配位数为。列式表示Al单质的密度g cm-3。
cm-3。
(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下:
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g)△H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g)△H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式。
2SO3(g)△H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式。
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是。
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K=。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g)△H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是。
CH3OH(g)△H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是。