(1)A、B、C为短周期元素,请根据下表信息回答问题。
| 元素 |
A |
B |
C |
| 性质或结构信息 |
工业上通过分离液态空气获得其单质,单质能助燃 |
气态氢化物的水溶液显碱性 |
原子有三个电子层,简单离子在本周期中半径最小 |
① 第一电离能:A B(填“>”、“<”或“ =”),基态C原子的电子排布式为 。
=”),基态C原子的电子排布式为 。
② B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为 。
(2)发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效
催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂
作用下合成甲醇(CH3OH),从而实现液化。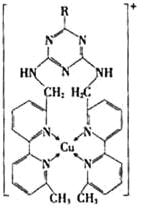
① 某含铜的离子结构如图所示:
在该离子内部微粒间作用力的类型有 。
a.离子键 b.极性键 c.非极性键
d.配位键 e.范德华力 f.氢键)(填字母)
② 煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键。请你说明甲醛分子间没有氢键原因 ;
③ 甲醇分子中进行sp3杂化的原子有 ;甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为 。
(8分)向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式__________________________________________________
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO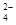 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
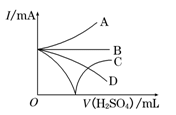
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是________(填序号).

(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________________________.
(12分) 铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示: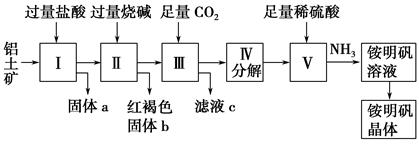
请回答下列问题:
(1)固体a的化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为。
从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1)L(计算结果请保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为。
(9分) 向浓度相等、体积均为50 mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100 mL。
(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
①;②;
③;④。
(2)在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如下图所示。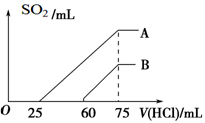
①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是________mL(标准状况)。
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为_________________。
③原KOH溶液的物质的量浓度为。
(9分) 在下列物质转化中,已知A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系: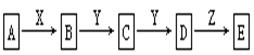
说明:当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SO3、H2SiO3皆为二元弱酸)
请回答下列问题:
(1)A是,Y是,Z是(填化学式,下同)。
(2)当X是强酸时,E是,写出B生成C的化学方程式: _____ 。
(3)当X是强碱时,E是,写出D生成E的离子方程式:。
(10分) 测得某金属冶炼厂的酸性工业废水中,含有一定量的Fe3+、Cu2+、Au3+等离子。按照“变废为宝”的原则,设计了下图中的回收流程,要求利用常见的酸、碱和工业生产中的废铁屑,从该工业废水中回收金、并生产化工原料铁红和氧化铜。
请你完成下面的问题:
(1)流程图中标号处需加入的相应物质分别是:①;②;
③;④;⑤。
(2)写出流程图中①处可能发生的所有反应的离子方程式: 。
(3)写出流程图中③处发生反应的化学方程式。