某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A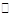 H++HA-,HA-
H++HA-,HA-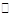 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 ;
(2)c(H2A)最大的是 ,最小的是 ;
(3)c(A2-)最大的是 ,最小的是 。
肼(N2H4)是火箭推进剂的成分之一,它与另一成分NO2反应生成N2和H2O,反应的化学方程式为,其中氧化剂是,该反应除产生大量的热量外,还有一突出的优点是.
锌与硝酸反应,若有1mol硝酸参加法院,则有0.8mol的电子发生转移,此时硝酸的还原产物中N元素的化合价 。
某无色混合气体可能有CO、CO2、NH3、HCl、H2、水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象),氢氧化钡溶液(有浑浊现象),浓硫酸、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,则可断定该混合气体中一定有 。
(4分)已知Ba(AlO2)2可溶于水。右图表示的是向KA1(SO4)2溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。完成下列问题:
(1)a点时反应的离子方程式是
(2)a、b两点消耗Ba(OH)2的物质的量之比是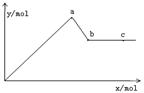
(共13分)关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3— 对人类健康会产生危害,为了降低饮用水中NO3—的浓度,可以在碱性条件下用铝粉将N O3-还原为N2,其化学方程式
O3-还原为N2,其化学方程式 为:
为:
10Al + 6NaNO3 + 4NaOH ="=" 10NaAlO2 + 3N2↑+ 2H2O。请回答下列问题:
①上述反应中,元素的化合价升高,则该元素的原子(填“得到”或“失去”)电子
②用“单线桥法”表示反应中电子转移的方向和数目:
10 Al+ 6 NaNO3 + 4 NaOH ="=" 10 NaAlO2 + 3 N2↑+ 2 H2O
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
②漂白粉的有效成分是(填化学式)。
③漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,离子方程式为
 。
。