三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 硝酸、1.0 mol·L-1 盐酸、1.0 mol·L-1 NaOH溶液、3% H2O2、0.1 mol·L-1 KI溶液、0.1 mol·L-1 CuSO4溶液、20% KSCN溶液、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过(A)澄清石灰水、浓氢氧化钠 (B)浓硫酸、灼热氧化铜 (C)澄清石灰水;观察到(A)、(C)中澄清石灰水都变浑浊,(B)中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 。
(3)固体产物中铁元素存在形式的探究。
① 提出合理假设
假设1: ;
假设2: ;
假设3: 。
② 设计实验方案证明你的假设
| 实验步骤 |
预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 |
固体部分溶解。 |
| 步骤2: |
|
| 步骤3: |
|
| |
|
(4)若假设1成立,K3[Fe(C2O4)3]分解反应的化学方程式为 。
实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。回答以下问题:
⑴化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)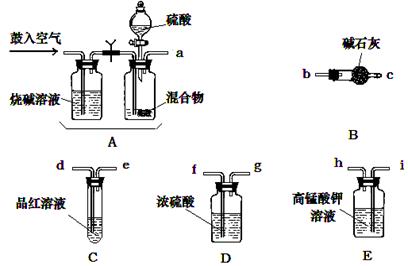
请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)
a→→→→→ f →g → →。
⑵实验开始,混合物加酸前,A装置需要鼓入空气,作用是;加酸后A装置再次鼓入空气的作用是。
⑶ E装置的作用是。
⑷实验中,若C瓶中溶液褪色,则测定结果可能会偏(填“高”或“低”)。为了确
保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol·L-1的KMnO4
溶液体积(V)不少于mL。
⑸若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质
量分数为。
⑹从定量测定的准确性考虑,该套装置还应作进一步的改进是。
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32
实验室用下列仪器组装一套蒸馏石油的装置,并进行蒸馏得到汽油和煤油。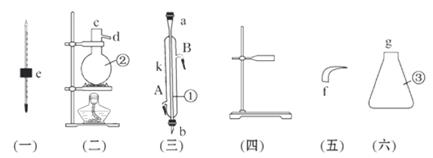
(1)写出下列仪器的名称:
①__________________;②___________________;③_________________。
(2)将以上仪器按从左到右顺序,用字母a、b、c……进行连接:
e接();()接();()接()接()
(3)①仪器的A口是__________,B口是__________。
(4)蒸馏时,温度计水银球应在______________________(位置)。
(5)在②中注入原油后,加几片碎瓷片的目的是_________________。
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和过氧化钠样品为原料,制取O2,设计出如下实验装置: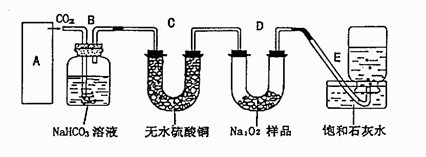
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:
B装置的作用是,C装置内可能出现的现象是。
(2)二氧化碳和过氧化钠反应的化学方程式为,
(3)为了检验E中收集到的气体,在取出集气瓶后,如何检测。
(4)若乙中的石灰水出现出现轻微白色浑浊,请说明原因:。
实验室欲配制0.5 mol·L-1的NaOH溶液500 mL有以下仪器:①烧杯②100 mL量筒③1 000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有(填代号) ,还缺少的仪器是
(2)需称量 g烧碱固体,固体应放在 中称量。
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为 。
(4)在配制过程中,其他操作都正确,下列操作会引起误差偏高的是 。
| A.未洗涤烧杯、玻璃棒 |
| B.未等NaOH溶液冷却至室温就转移到容量瓶中 |
| C.容量瓶不干燥,含有少量蒸馏水 |
| D.定容时俯视标线 |
E、摇匀后液面下降,补充水
(5分) 右图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(1)图中的两处明显的错误是
①;②。
(2)A仪器的名称是____________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,为防止液体暴沸还需加入少量_______。