M、Q、X、Y、Z是前四周期的5种元素,原子序数依次增大,其结构或性质信息如下表:
| 元素 |
结构或性质信息 |
| M |
M的一种单质是自然界最硬的物质 |
| Q |
基态原子最外层未成对电子数在该元素所在周期中最多 |
| Y |
单质常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
请回答以下问题:
(1)a.学生甲根据M原子易形成4对共用电子的特点,推出M原子应该具有4个未成对电子。画出基态M原子的价层电子排布图为 ,请判断对错,并加以解释
,请判断对错,并加以解释
b.M的另一种单质被称为混合型晶体,具有平面层状结构。M原子的杂化方式为________,其晶体中含有的作用力为________________________________________
(2)写出与Q单质分子互为等电子体的常见微粒的化学式(分子、阴离子各1个) 、 ;并写出该阴离子的 电子式___________
电子式___________
(3)a.学生乙通过查表,确定Q与Y的电负性接近。但是Q的氢化物分子间能形成氢键,X的氢化物分子间却不易形成氢键,试从结构的角度加以解释:
b.氢键的形成,对分子的沸点影响较大,请判断以下两种互为同分异构体的分子沸点高低:
邻羟基苯甲酸 ______ 对羟基苯甲酸,原因是_________________________________
c.含氧酸的酸性与非羟基氧的个数有关,则Y的四种常见的不同价态含氧酸的酸性由强到弱排序为:
I A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A;B;C。
(2)一段时间后,三个烧杯中的硫酸恰好全部被消耗,C中产生了3.36L(标准状况)气体,,则原稀硫酸溶液的物质的量浓度= mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为:(填写序号) 。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是(填写序号)。
Ⅱ某科研单位利用电化学原理用SO2来制备硫酸,装置如下图,含有某种催化剂。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
(1)通入SO2的电极为________极,其电极反应式为______________________,此电极区pH________(填“增大”“减小”或“不变”)。
(2)电解质溶液中的H+通过质子膜________(填 “向左”“向右”或“不”)移动,通入氧气的电极反应式为________________________________。
(I)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② |
||||
| ③ |
粗颗粒 |
|||
| ④ |
(II) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)=;
(2)用O2表示从0~2s内该反应的平均反应速率为;
(3)右图中表示NO2变化的曲线是;
(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V②体积不变充入He气体 V
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)用电子式表示AmC的形成过程___________________。
(2) 、
、 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为:_____________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:1混合,写出该反应的离子方程式。该溶液的溶质含有的化学键类型是
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
(1)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是(填序号),写出反应⑥的化学方程式______。
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:i.反应A中, 4mol HCl被氧化,放出115.6 kJ的热量。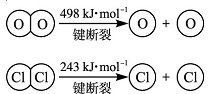 ①H2O的电子式为__________。
①H2O的电子式为__________。
②反应A中反应物的总能量_____________ 生成物的总能量。(填“大于、小于或等于”)
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键________(填“强”或“弱”)。
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)参照下图溶解度曲线,固体A是________(写化学式);固体B是________(写化学式);欲得到较纯的固体B需用少量的________(填“热水”或“冷水”)洗涤固体。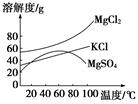
(2)操作⑤是实验室常用的过滤方法——减压过滤(俗称抽滤)。请问这种过滤方法其优点是____________________________________________________________。