A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1) 用电子式表示AmC的形成过程___________________。
(2)  、
、 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3) 将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为:_____________。
(4) 常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:1混合,写出该反应的离子方程式 。该溶液的溶质含有的化学键类型是
(5) 在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
(本题共8分)
现有200mL混合溶液,其中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其它反应)
(1)滴入少量氯水时被氧化的元素是,氧化产物是(填化学式)
(2)若有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是。
(3)若原溶液中Br—有一半被氧化,共消耗Cl2的物质的量为,若最终所得溶液为400mL,其中主要阳离子的物质的量浓度为。
(4)往上述反应后的溶液中滴入淀粉溶液,溶液变蓝。继续滴入过量氯水,蓝色褪去,试写出有关反应的离子方程式并分析电子转移情况:
。
部分中学化学常见元素原子结构及性质如表所示
| 序号 |
元素 |
结构及性质 |
| ① |
A |
A在第三周期中简单离子半径最小 |
| ② |
B |
B原子最外层电子数是内层电子数的1/5 |
| ③ |
C |
C是常用化肥的主要元素,单质常温下呈气态 |
| ④ |
D |
通常情况下,D没有正化合价,A、B、C都能与D形成化合物 |
| ⑤ |
E |
E在周期表中可以排在IA族,也可以排在ⅦA族 |
(1)A原子中的电子占有______个轨道,最外层有______种不同运动状态的电子。这五种元素的原子半径由大到小的顺序为_________________(用元素符号表示)。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为______________________________________。E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,M的空间构型为___________,N的结构式为___________。
(3)C与D都是较活泼的非金属元素,用一个有关的化学方程式说明两种单质的氧化性强弱_____________________________________。
(4)有人认为A、B的单质用导线连接后插入NaOH溶液中可形成原电池,你认为是否可行,若可以,写出负极的电极反应式(若认为不行可不写)________________________。
随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min- D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
下列是模拟石油深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程: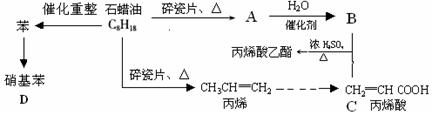
请回答下列问题:
(1)A的结构简式为:
(2)CH2=CHCOOCH2CH3的含氧官能团(填名称)
(3)写出下列化学反应方程式
①B+C→CH2=CHCOOCH2CH3:
②丙烯→聚丙烯:
③苯→硝基苯如何加热?:。其优点是。
(4)目前制备酒精的方法有两种:
方法一: 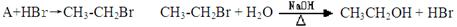
方法二: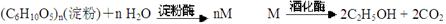
①对方法一所涉及的有机反应类型分别为:,
②对于方法二, M的分子式为:
③下列说法正确的是____________(填代号)
A、从绿色化学的角度看方法一的原子利用率100%
B、从原料的可再生性来说,方法二最好
C、方法二产物乙醇储藏的化学能来自于太阳能
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为。
(2)N≡N的键能为942 kJ·mol-1,N—N单键的键能为247 kJ·mol-1,计算说明N2中的键比键稳定。(填“σ”或“π”)
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴阳离子组成,熔点低于100 ℃,其挥发性一般比有机溶剂(填“大”或“小”),可用作(填代号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是,与同一个N3-相连的X+有个。