已知:N2(g)+3H2(g) 2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是
2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是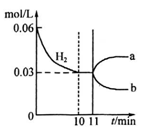
| A.10~11min该反应的速率为v(H2)>0.003mol/(L·min) |
| B.若改变所用催化剂时,△H 会发生变化 |
| C.若将上述密闭容器换作绝热密闭容器,其余条件不变,NH3的产率将降低 |
| D.从11min起其它条件不变,压缩容器的体积,则c(H2 )的变化曲线为b |
已知碳、一氧化碳、晶体硅的燃烧热分别是△H =-393.5kJ/mol、△H ="-283" kJ/mol和△H ="-989" kJ/mol,则工业冶炼晶体硅反应2C(s)+SiO2(s)=" Si" (s)+2 CO(g) △H =
| A.+768 kJ/mol | B.-768 kJ/mol | C.+2342 kJ/mol | D.-2342 kJ/mol |
某有芳香烃的分子式为C8H10,其分子中烷基碳上的氢被氯原子取代所得同分异构体有两种,则该有机物苯环上的氢被氯原子取代的同分异构体的种数为(不考虑立体异构):
| A.1 | B.2 | C.3 | D.4 |
下列关于有机物的说法错误的是:
| A.人们习惯称糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质 |
| B.葡萄糖、果糖、蔗糖、麦芽糖分子式完全相同,但结构不同,因此它们互为同分异构体 |
| C.人工方法合成的酯可以用作饮料、糖果、香水、化妆品中的香料 |
| D.通过石油裂化和裂解可以得到乙烯、丙烯、甲烷等重要的化工基本原料 |
下列反应对应的离子方程式书写正确的是:
| A.用氢氟酸在玻璃上“刻字”:SiO2+4H++4F-=SiF4↑+2H2O |
| B.实验室制取氯气:2MnO4-+8H++6Cl-=2MnO2↓+3Cl2↑+4H2O |
| C.将铁粉放入硫酸铁和硫酸铜的混合溶液中,初始阶段发生的反应:Fe+2Fe3+=3Fe2+ |
| D.常温下,铁与过量的浓硝酸反应:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
| A.离子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均只有一种 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |