(15分)随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,其具体操作步骤如下:①用分析天平称取研细干燥的NaCl固体 g于体积为V1毫升的定容容器A中;②用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题:
g于体积为V1毫升的定容容器A中;②用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题:
(1)定容容器A最好用________________(填实验仪器名称);
(2)滴定管是用酸式滴定管还是用碱式滴定管?_____________________,为什么?
______________________________________________________________;
(3)能否用水代替苯?_____________,为什么?
_______________________________________________________;
(4)测定离子化合物中离子间的间隔的方法是用X—射线衍射法,已知X—射线衍射仪测出的NaCl晶体中相邻Na+和Cl-的核间距为 cm。则利用上述方法测得的阿伏加德罗常数的数学表达式为:
cm。则利用上述方法测得的阿伏加德罗常数的数学表达式为: ______________________;
______________________;
(5)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分比为:______________。
选做【化学——选修2:化学与技术】海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用 (写一点即可)。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题: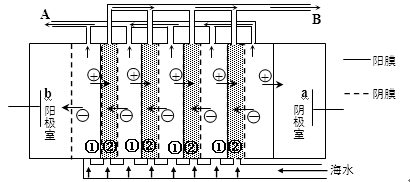
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下: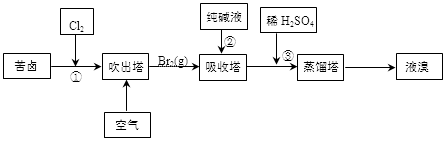
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑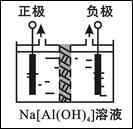
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是_____________________。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是__________________________。
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 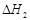
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应:CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。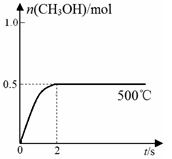
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,原因
是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为: 。
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。(填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
【改编】(15分)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制装置,请你说出一种温度控制方法 ,B部分还应补充什么装置 ;
②C中烧杯中所盛试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为 。
(3)工业也可以用CH3OH与NaClO3为原料在酸性(硫酸酸化)条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+ ="=" 2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
③生产中会发生副反应ClO3-+Cl-+H+ ="=" Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为 ,则起始投料时CH3OH与NaClO3的物质的量之比为 。
,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(4)Na2FeO4在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时生产一种无色无味的单质气体,写出Na2FeO4与水反应的离子方程式 ;Na2FeO4可作为一种“绿色多功能”水处理剂的原因是 。
【改编】(16分)CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍。具体反应为: ,该正反应的ΔH 0(选填“>”或“=”或“<”)。
,该正反应的ΔH 0(选填“>”或“=”或“<”)。
(2)工业上可利用CO生产乙醇:2CO(g)+4H2(g)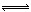 CH3CH2OH(g)+H2O(g)ΔH1
CH3CH2OH(g)+H2O(g)ΔH1
又已知:H2O(l) ="==" H2O(g)ΔH2
CO(g)+H2O(g) 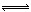 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)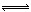 CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(3)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)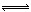 CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有___ 。
A.2v(H2) =" v(CO)"
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应CO(g)+2H2(g)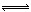 CH3OH(g)
CH3OH(g)
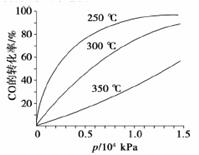
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
①合成甲醇的反应为__ __(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为__ __L。
④下图中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图。
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是 。