I. 科研人员发现,一些化学反应在固体之间发生和在水溶液中发生,产物不同。铜合金是人类使用最早的金属材料,铜在化合物中的常见化
科研人员发现,一些化学反应在固体之间发生和在水溶液中发生,产物不同。铜合金是人类使用最早的金属材料,铜在化合物中的常见化 合价有+1、+2。将CuCl2·2H2O晶体和NaOH固体混合研磨,生
合价有+1、+2。将CuCl2·2H2O晶体和NaOH固体混合研磨,生 成物中有一黑色的固体M。M不溶于水,但可溶于稀硫酸生成蓝色溶液B。
成物中有一黑色的固体M。M不溶于水,但可溶于稀硫酸生成蓝色溶液B。
M的化学式为 ;M不同于CuCl2和NaOH在溶液中反应所得产物的可能原因是
。
II.A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体 ,则Y的电子式是 ,该反应的化学方程式是: 。
,则Y的电子式是 ,该反应的化学方程式是: 。
(2)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中
①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是 。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是____mol。
(3)若A、B、X、Y均为化合物。A溶 于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO33溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是 。
于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO33溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是 。
存在于茶叶中的有机物A,其分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种。A遇FeCl3溶液发生显色反应。F分子中除了2个苯环外,还有一个六元环。它们的转化关系如下: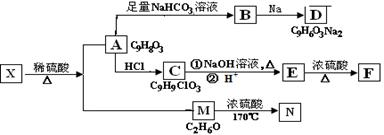
请回答下列问题:
(1) 有机物A中含氧官能团的名称是。
(2) A→B的化学方程式是。
(3)E→F的反应类型是。
(4)1mol A与Br2 反应,最多可消耗Br2 的物质的量是mol。
(5)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有种(不包括R)。
(6)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学
方程式。
下列框图表示各有关物质之间的转化关系,所有反应物、生成物及溶液中的水均未标出。已知常温下D、E、F、H、L、N均为气体;A的焰色反应呈黄色;向B的溶液中滴加KSCN溶液,无明显现象;1molB隔绝空气分解得到F、G、H三种氧化物,其物质的量均为1mol;F是易与血红蛋白结合的物质;J是现代社会中应用最广泛的金属单质。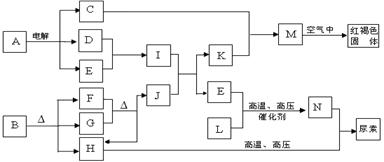
请回答下列题:
(1)构成单质J的元素在周期表中的位置是。
(2)B的化学式; N的空间构型是。
(3)写出M在空气中变为红褐色固体的化学方程式。
(4)D与E反应可制得一种重要的化工原料I,其反应的现象是。
(5)N与H在高温高压下能合成尿素[CO(NH2)2],其反应的化学方程式为
。
【化学—有机化学基础】
(1)有机物X的相对分子质量小于100,1mol 有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下O2112L。
有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下O2112L。
①该有机物X的分子式为。
A.C4H8B.C2H4O C.C4H8O2D.C10H20C20
②若X能发生银镜反应,但不能发生水解反应,且能与Na反应产生氢气,则其可能的结构有种。
(2)对氨基水杨酸钠是一种抑制结核杆菌的药物,合成路线如下: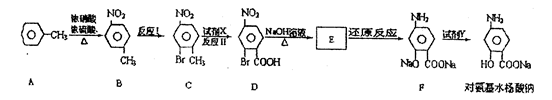
①化合物D中显酸性官能团的名称是。
②下列说法正确的是 。
。
A.反应I属于取代反应,反应II属于氧化反应
B.对氨基水杨酸钠既能与盐酸反应,也能与氢氧化钠溶液反应
C.化合物A—F均属于芳香烃
D.试剂X可为KMnO4,试剂Y可为过量盐酸
③由A生成B的反应方程式为(注明反应条件)
④化合物E的结构简式为。
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为。
(2)熔沸点:NH3PH3(>、<、=)原因是
(3)N、P、As三种元素电负性由小到大的顺序为,NCl3分子中中心原子的杂化方式为。
(4)汽车尾气中CO和NO 经催化剂作用变成N2和CO
经催化剂作用变成N2和CO 2,此反应中三种元素第一电离能由小到大的顺序为,在这四种物质中含有极性键的非极分子内
2,此反应中三种元素第一电离能由小到大的顺序为,在这四种物质中含有极性键的非极分子内 键和
键和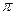 键的比为。
键的比为。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有,配位体为。
| A.氢键 | B.离子键 | C.共价键 | D.配位键[E.范德华力 |
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子 对,则[Cu(NH3)n]+中n的值为
对,则[Cu(NH3)n]+中n的值为 。
。
I。锂——空气电池能够提供相当于普通锂离子电池10倍的能量,因此它是很有前途的电池技术。下图是锂——空气电池放电时的工作示意图。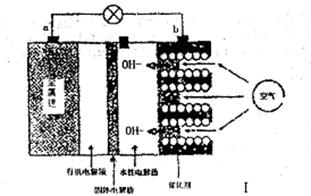
(1)图1中电极a是极。
(2)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过防止Li和这些物质反应。Li和水在常温下发生反应的化学方程式为。
II.某些锂电池广泛应用于手机、数码相机及便携式电脑中。此种锂电池的负极通常由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成。总反应为:4Li+2SOCl2=4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生。以下说法中正确的是。
| A.放电时电池内部Li+向负极移动[ |
| B.放电过程中,电池负极发生氧化反应 |
| C.放电时每移动2mol电子,有1molS被还原 |
D.放电时电池正极反应为 :3SOCl2+4e-=SO2+S+4Cl- :3SOCl2+4e-=SO2+S+4Cl- |
III.锂电池回收具有重要意义,重点回收的正极材料,其主要成分为钴酸锂(LiCoO2)、铝箔等。
某回收工艺流程如下: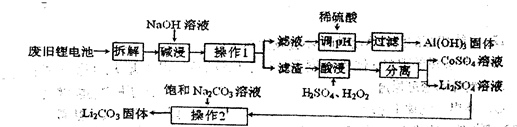
(1)废旧电池残留有单质锂,拆解时需隔绝空气,是因为锂易与空气中的 反应。
反应。
(2)酸浸时钴酸锂发生反应的化学方程式为。若用盐酸代替H2SO4、H2O2混合液也能达到酸浸目的,但不利之处是。
(3)Li2CO3在水中的溶解度随温度升高而减小,操作2的步骤是:加热浓缩析出晶体、、洗涤、干燥。