下列框图表示各有关物质之间的转化关系,所有反应物、生成物及溶液中的水均未标出。已知常温下D、E、F、H、L、N均为气体;A的焰色反应呈黄色;向B的溶液中滴加KSCN溶液,无明显现象;1molB隔绝空气分解得到F、G、H三种氧化物,其物质的量均为1mol;F是易与血红蛋白结合的物质;J是现代社会中应用最广泛的金属单质。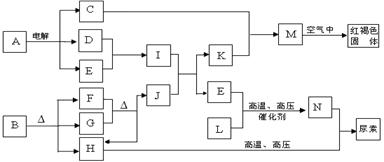
请回答下列题:
(1)构成单质J的元素在周期表中的位置是 。
(2)B的化学式 ; N的空间构型是 。
(3)写出M在空气中变为红褐色固体的化学方程式 。
(4)D与E反应可制得一种重要的化工原料I,其反应的现象是 。
(5)N与H在高温高压下能合成尿素[CO(NH2)2],其反应的化学方程式为
。
(6分)根据题目要求书写化学用语
(1)写出符合SO42—+ Ba2+= BaSO4↓的化学方程式
(2)写出实验室制二氧化碳的离子方程式
(3)氯水滴入硝酸银溶液的化学方程式
有机物I是制备液晶材料的重要中间体,其合成途径如下:
已知:一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的核磁共振氢谱有2种峰,则A的结构简式为。
(2)C的系统命名法为。
(3)反应Ⅳ在(1)条件下的离子方程式为。
(4)反应Ⅰ→Ⅴ中属于氧化反应的有。
(5)根据反应Ⅱ的信息完成以下反应方程式: 。
。
(6)为反应Ⅲ设计所需试剂与条件是:。
(7)已知X为E的同分异构体,X与硬酯酸甘油脂具有相同的官能团,还能发生银镜反应。写出所有满足条件的X的结构简式:。
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______;ΔH___0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率______(选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为______。
A(g)+B(g)的平衡常数的值为______。
黄铜矿CuFeS2可用于冶炼铜,冶炼原理为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2。
(1)黄铜矿冶炼铜产生的炉渣中主要含Fe2O3、FeSiO3、SiO2、Al2O3等,请完成以下验证炉渣中含有+2价的铁的探究过程中的有关问题:
仅限选择的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水
①应选用试剂为。
②有关的实验现象为。
(2)据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O。利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
①操作a的名称是,操作b的操作方法是。
②检验溶液B中Fe3+是否被除尽的试剂是,证明Fe3+已被除尽的现象是。
③在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案的化学方程式:
方案一:;方案二:。
(本题共15分)二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟有左下图所示的装置模拟制取并收集ClO2。
(1)B必须放在冰水浴中控制温度,其原因是;
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
a;b;③洗涤;④干燥。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知2 Na2S2O3 + I2 →Na2S4O6 + 2NaI)
①配制70 mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:。
②步骤2中发生反应的离子方程式为:。
③判断滴定终点的现象。
原ClO2溶液的浓度为g / L(用步骤中的字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果;若滴定开始仰视读数,滴定终点时正确读数,则测定结果。(填 “偏高”“偏低”或“不变”)