常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。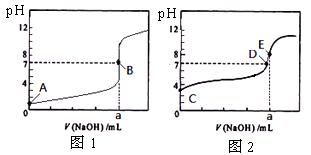
若以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A—) >c(Na+)> c(H+) > c(OH—)
25℃ 时,向1 mL pH=1的硫酸中滴加的10 mL pH=b的NaOH溶液,形成的混合溶液成碱性则b可能为
| A.10 | B.11 | C.12 | D.13 |
300mL硫酸铝溶液中,含铝离子为1.62g,在该溶液中加入0.1mol/L氢氧化钡溶液100mL,反应后溶液中硫酸根离子的物质的量浓度约为
| A.0.4mol/L | B.0.3mol/L | C.0.2mol/L | D.0.1mol/L |
离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+中H+不能代表的物质是
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
| A.①③ | B.①④⑤ | C.①⑤ | D.②④⑤ |
已知反应①KClO3+6HCl=3Cl2+KCl+3H2O②2KBrO3+Cl2=Br2+2KClO3③Cl2+2KBr=2KCl+Br2。下列说法正确的是
| A.上述三个反应都有单质生产,所以都是置换反应 |
| B.氧化性由强到弱的顺序为KBrO3 >KClO3 >Cl2 >Br2 |
| C.反应①中还原剂与氧化剂的物质的量之比为6:1. |
| D.若反应②中有1 mol还原剂参加反应,则氧化剂得电子的物质的量为2 mol |
设NA代表阿伏伽德罗常数的值,下列说法正确的是
| A.2.3g钠与水反应失去的电子数目为0.2NA |
| B.20℃、101Kpa时,5.6L氨气所含的原子数目为NA |
| C.0℃、101Kpa时,18g铵根离子所含有的电子数为10NA |
| D.1mol氯化钠固体溶于1L水所得的溶液中氯化钠的物质的量浓度为1mol/L |