Ⅰ.已知:R-CH=CH-O-R′ 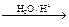 R-CH2CHO + R′OH
R-CH2CHO + R′OH
(烃基烯基醚)
烃基烯基醚A的相对分子质量(M r)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
请回答下列问题:
⑴ A的分子式为_________________,B的名称是___________________。
⑵写出C → D反应的化学方程式:_______________________________________。
⑶链烃M的相对分子质量比B多24,分子中所有碳原子均在同一平面上,
其结构简式是 。
Ⅱ.由E转化为对甲基苯乙炔(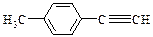 )的一条路线如下:
)的一条路线如下: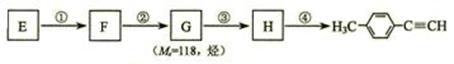
⑷①反应中所加试剂是 ; ③ 的反应类型是 。
⑸写出G的结构简式:____________________________________。
⑹写出两种同时符合下列条件的E的同分异构体的结构简式:_________________________、________________________。
① 属于芳香醛;
② 苯环上有两种不同环境的氢原子。
为探究某抗酸药X的组成,进行如下实验:
查阅资料:
①抗酸药X可能的组成可以表示为:MgmAln(OH)p(CO3)q(SiO3)r(m、n、p、q、r为≥0的整数)。
② 在pH=5.0时沉淀完全;
在pH=5.0时沉淀完全; 在pH=8.8时开始沉淀,pH=11.4时沉淀完全。
在pH=8.8时开始沉淀,pH=11.4时沉淀完全。
实验过程:
| 步骤 |
实验操作 |
实验现象 |
| I |
向X的粉末中加入过量盐酸 |
产生气体A,得到无色溶液 |
| II |
向Ⅰ所得的溶液中滴加氨水,调节pH至5~ 6,过滤 |
生成白色沉淀B |
| III |
向沉淀B中加过量NaOH溶液 |
沉淀全部溶解 |
| IV |
向II得到的滤液中滴加NaOH溶液,调节pH至12 |
生成白色沉淀C |
(1)Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是。
(2)II中生成B反应的离子方程式是。
(3)III中B溶解反应的离子方程式是。
(4)沉淀C的化学式是。
(5)若上述n(A)︰n(B)︰n(C)=1︰2︰3,则X的化学式是。
某小组用铜屑制取硫酸铜溶液。将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气其反应原理为2Cu+O2+2H2SO4 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
(1)参加反应的氧气在标准状况下的体积是。
(2)所得硫酸铜溶液的物质的量浓度是。
(3)取100 mL上述硫酸铜溶液,加水稀释至0.1 mol/L,稀释后硫酸铜溶液的体积是。
现有分子式为C10H10O2Br2的芳香族化合物X,X中苯环上有四个取代基,苯环上的一氯代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。
已知:
①在稀碱溶液中,连在苯环上的溴原子不易发生水解
②两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动发生脱水反应:
CH3CH(OH) 2→CH3CHO +H2O
回答下列问题:
(1)X中官能团的名称是,C的结构简式为
(2)E→F反应类型是
(3)I的结构简式为;
(4)E不具有的化学性质(选填序号)
a、取代反应b、消去反应
c、氧化反应d、1molE最多能与1mol NaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:
②B→C的化学方程式:;
(6)同时符合下列条件的E的同分异构体共有种,
a、苯环上的一氯代物有两种 b、不能发生水解反应 c、遇FeCl3溶液不显色
d、1molE最多能分别与1molNaOH和2molNa反应
其中核磁共振氢谱为六组峰,且峰面积比为3:2:2:1:1:1的一种结构简式为。
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为。
(2)B、C、D的第一电离能由小到大的顺序为。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是.
(4)E的最高价氧化物分子的空间构型是。其中心原子的杂化方式为。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为。
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为g/cm3。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在(填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式;
(3)K2FeO4可作为新型多功能水处理剂的原因;
(4)与MnO2 -Zn电池类似,K2FeO4 -Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是①,②;
(6)从“反应液II ”中分离出K2FeO4后,副产品是(写化学式)。