X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
回答下列问题:(各元素用相应的元素符号表示)
⑴写出 X和Y形成的化合物的电子式 。
X和Y形成的化合物的电子式 。
⑵阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反
应的化学方程式 

⑶写出反应②的化学方程式为 。
⑷某温度下在容积固定的密闭容器中,下列反应达到平衡:
M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
| n(M):n(H2O) |
M转化率 |
H2O转化率 |
| 1:1 |
0.5 |
0.5 |
| 1:2 |
0.67 |
0.335 |
| 1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=
—44kJ/mol,写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、
2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
| A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低 |
| B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同 |
| C.M和H2O(g)初始物质的量之比等于二者转化率之比 |
| D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85 |
氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下 (金属离子含量与pH、CuCl产率与混合液中pH的关系图)
(金属离子含量与pH、CuCl产率与混合液中pH的关系图)
请回答下列问题:
(1)电镀污泥的主要成分是(写化学式);
(2)酸浸时发生反应的离子方程式是;
(3)析出CuCl晶体时的最佳pH在左右;
(4)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
;
(5)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是。
(1)某温度下,密闭容器中,发生如下可逆反应:2E(g) F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
①若X=1,容器体积保持不变,新平衡下E的体积分数为________.
②若X=2,容器体积保持不变,新平衡下F的平衡浓度____0.5a mol/L。
(2)t℃将3mol A气体和1mol B气体通入2L固定体积的密闭容器中,发生如下反应:3A(g) + B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
①从开始反应至达到平衡状态,生成C的平均反应速率为_________,X=_____.
②若继续向原平衡混合物中通入少量氦气(不参与反应)后,化学平衡将____移动。
③若向原平衡混合物的容器中再充入a molC,在t℃达到新的平衡,此时B的物质的量为n(B)=_____________mol。
④如果上述反应在相同温度和容器中进行,欲使反应达到平衡时物质的量分数与原平衡时相同,起始加入的三种物质的物质的量n(A)n(B) n(C)之间应该满足的关系为_____________________.
根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120,M为海水中含量最多的无机盐。
(1)I元素在元素周期表中的位置;M中阴离子的结构示意图:。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为。
(3)写出下列化学反应的离子方程式:
①溶液P与KSCN溶液:________________________________________;
②G与N的反应:______________________________________ ____ ______;
______;
③K与L的反应:___________________________________ _____________。
(4)已知每生成16 gD,放出106.5 kJ热量,则反应①的热化学方程式为:
已知某溶液只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下关系:
①c(Cl-)> c(NH4+) > c(H+) > c(OH-)②c(NH4+) > c(OH-) > c(Cl-)>c(H+)
③c(NH4+) > c(Cl-)> c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+) > c(OH-)
填写下列空白:
⑴若溶液中只有一种溶质,则该溶质是_________________,上述四种离子浓度的大小顺序(填序号)______________。
⑵若四种离子的关系符合③,则溶质为______________;若四种离子的关系符合④,则溶质为______________
⑶将pH相同的溶液稀释相同的倍数,下面图像正确的是(填图像序号)______________。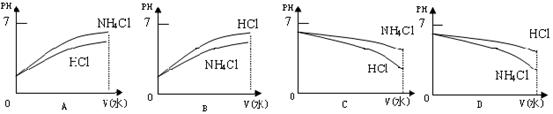
⑷若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O)(填“>”、“=”、“<”);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)_______c(OH-) (填“>”、“=”、“<”)。
已知:一个碳原子上连有两个羟基时,易发生下列转化:
请根据下图作答: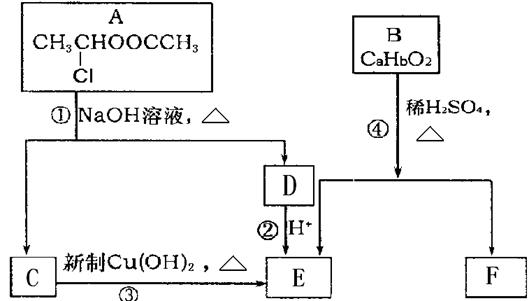
(1)A的核磁共振氢谱中出现 组峰;E中含有的官能团的名称是。
组峰;E中含有的官能团的名称是。
(2)反应③的化学方程式为。
(3)已知B的相对分子质量为162,其完全燃烧的产物中CO 2和H2O的物质的量之比为 n(CO2)︰n(H2O)=2︰1,则B的分子式为。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:
①属于芳香族化合物;②能跟FeCl3溶液发生显色反应;
③能发生加聚反应;④苯环上的一氯代物只有两种。
F在一定条件下发生加聚反应的化学方程式为 。
(5)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有种结构,写出其中不含甲基的同分异构体的结构简式。