甲、乙两同学为探究与可溶性钡的强酸盐能否反应生成白色沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)

实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中  产生白色沉淀,液面上放略显浅棕色并逐渐消失 产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入, 停止加热,一段时间后关闭 |
|
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是。
(2)C中白色沉淀是_,该沉淀的生成表明具有性。
(3)C中液面上方生成浅棕色气体的化学方程式是_。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是;
乙在A、B间增加洗气瓶D,D中盛放的试剂是。
②进行实验,B中现象:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。
(12分)实验室有一瓶密封不严的漂白粉,请利用以下仪器和试剂,完成该漂白粉成分的探究。试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。
(1) 提出假设:假设一:该漂白粉未变质,含________________________。
假设二:该漂白粉全部变质,含________________________。
假设三:该漂白粉部分变质,含CaCl2 , Ca(ClO)2 ,CaCO3
(2)进行实验:在答题卡上完成下表(不必检验Ca2+、Cl-)
| 实验步骤 |
预期现象和结论 |
|
| ① |
用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管加入__________ |
若无气体放出且澄清石灰水未见浑浊,则假设________成立: |
| ② |
||
| ③ |
(20分)A、B、C、D、E、F、G、H、I、J均为有机化合物。根据以下框图,回答问题: ( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为____;
(3)⑤的化学方程式是_____________________________________________;
⑨的化学方程式是______________________________________________;
(4)③的反应类型是______,④的反应类型是_____,⑦的反应类型是________;
(5)与H具有相同官能团的H的同分异构体的结构简式为______________。
(共9分)现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。回答有关问题:
(共13分)(1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
回答下列问题:
①气体X的分子式是。
②所选择的药品a是,b是, c是。
③下列装置乙和丙,能代替装置甲的简易装置是(填“乙”或“丙”)
④请写出在试管a中所发生反应的化学方程式。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出;;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为(填“正确”或“不正确”),依据是:;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象:。
(共6分)实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:( ×100℅)
×100℅)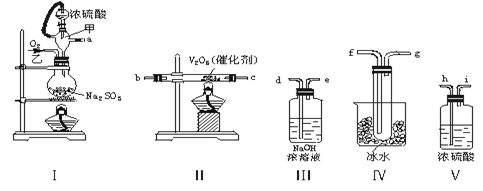
(1)这些装置的连接顺序(按气体左右的方向)是→→→→→→→→(填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是。
(4)Ⅳ处观察到的现象是。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为。