“冶炼金属常用以下几种方法:
①热还原法 ②离子交换法 ③电渗析法 ④电解法 ⑤热分解法。
下列金属各采用哪种方法还原最佳(用序号填写下列空白)。
(1)Na、、Al等活泼或较活泼金属 。(2)Hg、Ag等不活泼金属 。
(3)Fe、Zn等金属______________________
(12分)从物质X出发有如下图所示的一系列变化。已知X为酸式盐,A、C为无色气体,反应的某些产物已经略去。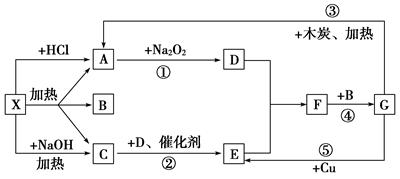
(1)写出下列物质的化学式:X:___________________________________________;
G:____________________。
(2)写出反应②的化学方程式:__________________________________________________。
(3)向X的溶液中加入过量的NaOH溶液,并加热,写出该反应的离子方程式:
_______________________________________________________________________。
(4)反应④中氧化剂与还原剂的质量之比为____________________________。
(10分)按照一定标准,根据物质与水反应的不同情况,对下列物质进行分类,如图所示,请填空:
(1)上图中分类标准1(分成A、B组的依据)为_______________________________。
(2)工业上常用D组中________(填化学式),来消除C组中物质对大气的污染,该反应的化学方程式为_____________________________________________________。
(3)实验室由Al3+制备Al(OH)3时,应选择D组中________(填化学式)的水溶液,离子方程式为__________________________________________________________________。
(4)F组中有两种物质,在工业上均有重要的用途,请各写出一个化学方程式表示其用途:
________________________________________________________________________;
________________________________________________________________________。
(10分)(1)下列实验方法合理的是________。
| A.用加热法除去食盐固体中的氯化铵 |
| B.将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取 |
| C.实验室制取Al(OH)3:往AlCl3溶液中加入NaOH溶液至过量 |
| D.往FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质 |
(2)SiO2广泛存在于自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式
________________________________________________________________________。
(3)铝是一种重要金属:铝与NaOH溶液反应的离子方程式为:
________________________________________________________________________。
(4)将10.7 g氯化铵固体与足量消石灰混合加热使之充分反应。生成气体在标准状况下的体积是________L。
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:
PbO2→Pb2O3→Pb3O4→PbO。
现将amol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
(1)试写出Pb2O3与浓盐酸反应的化学方程式__________________________
(2)通过计算确定y与a、x的函数关系式____________________
(3)若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为___;其物质的量之比为________________。
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中会分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是。
(2)Ⅱ中,需加一定量酸,该酸最好是。运用化学平衡原理以及离
方程式简述该酸的作用。
(3)Ⅲ中,生成FeCO3的离子方程式是。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 =2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是kg。