海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。
实验室里从海藻中提取碘的流程如下图: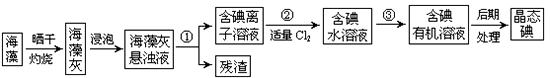
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;
过程②中有关反应的离子方程式为 。
(2)提取碘的过程中,可供选择的有机试剂是
| A.甲苯、酒精 | B. 四氯化碳、苯 四氯化碳、苯 |
C.汽油、乙酸 | D.汽油、甘油 |
(3)从含碘的有机溶液中提取碘和回收有 机溶剂,还须经过蒸馏,指出右面实验装置图中的错误之处:
机溶剂,还须经过蒸馏,指出右面实验装置图中的错误之处:
① ;
② ;
③ 。
常温下,将HCl溶液和一元碱AOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HCl物质的量浓度(mol·L-1) |
AOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.1 |
c |
pH=7 |
| 丙 |
0.1 |
0.1 |
pH=5 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明AOH是强碱还是弱碱。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.1________(选填“是”或“否”)。
(3)丙组实验所得溶液中由水电离出的c(OH-)=________mol·L-1。
为了验证Cu和浓H2SO4反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置: B中有无水硫酸铜、C中有品红溶液、D中有氢氧化钠溶液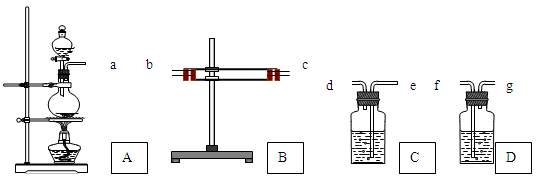
(1) 如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
a接,接,接;
(2) 仪器B、C应有怎样的实验现象才表明已检验出SO2和H2O?
B中,C中;
若将 B、C装置前后对调,对实验有何影响
。
(3) D中氢氧化钠溶液的作用是;
(4) 写出A中反应的化学方程式。
实验室利用图所示装置进行NaHCO3的受热分解实验。请回答: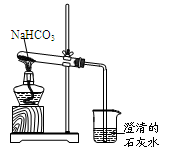
(1)加热一段时间后,烧杯中观察到的实验现象是。
(2)实验结束时的正确操作是(填序号),否则会引起。
①先将导管从液体中移出,再熄灭酒精灯
②先熄灭酒精灯,再将导管从液体中移出
(3)NaHCO3受热分解的化学方程式是。
控制变量法是研究化学变化规律的重要思想方法,请仔细观察表中100mL稀盐酸和2g Zn反应的实验数据:
| 实验序号 |
锌的 状态 |
C(HCl) mol/L |
溶液温度℃ |
锌消失时间(s) |
|
| 反应前 |
反应后 |
||||
| 1 |
粒状 |
0.5 |
20 |
39 |
400 |
| 2 |
粒状 |
0.6 |
20 |
41 |
310 |
| 3 |
粉末 |
0.5 |
20 |
40 |
280 |
| 4 |
粒状 |
0.8 |
20 |
40 |
200 |
| 5 |
粉末 |
0.8 |
20 |
40 |
30 |
| 6 |
粒状 |
1.0 |
20 |
40 |
120 |
| 7 |
粒状 |
1.0 |
30 |
50 |
40 |
| 8 |
粒状 |
1.2 |
20 |
40 |
90 |
| 9 |
粒状 |
1.2 |
25 |
45 |
40 |
分析并回答下列问题:
(1)本反应属于反应(填“吸热”或“放热”)。
(2)实验6和7表明:对反应速率有影响,反应速率越快,能表明同一规律的还有(填实验序号);
(3)根据实验1、2、4、6、8可以得出的条件对反应速率的影响规律是:;
(4)本实验中影响反应速率的其他因素还有,能表明这一规律的实验序号是1、3与。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由。